大学院医系科学研究科 教授 野村 渉
Tel:082-257-5308 FAX:082-257-5309
E-mail:wnomura*hiroshima-u.ac.jp
(注: *は半角@に置き換えてください)
●独自に開発している細胞周期(※1)を利用したゲノム編集(※2)の正確性をさらに向上させることに成功した。
●これまでに知られている高精度タイプのCRISPR-Cas9(※3)変異体のいくつかでは比較的高い相同組換え(※4)効率を示すことが確認された。
●自律的なゲノム編集活性の制御はin vivoゲノム編集(※5)の正確性向上にもつながると期待できる。
広島大学大学院医系科学研究科 松本 大亮助教、濁川 清美助教、野村 渉教授の研究グループは、細胞周期を利用した正確で安全なゲノム編集に高精度タイプのCRISPR-Cas9を適用することで更に正確性が向上することを見出しました。
これまでに、細胞周期に依存して発現量が増減するタンパク質をゲノム編集に利用することで、自律的に遺伝子の切断が制御され、CRISPR-Cas9酵素単独でゲノム編集を行う従来の方法と比較して相同組換えによる正確な配列編集効率が最大で5倍程度向上し、類似配列での誤った編集を最大で80%程度低減させることが可能になることを報告しています(図1)。この方法はCRISPR-Cas9活性が自律的に制御できるため、化合物や光刺激を利用したゲノム編集方法では困難であったin vivoゲノム編集技術などへの応用が期待されています。
新たに高精度タイプのCas9を適用したことで、これまでは難しかった不正確なゲノム編集(非相同末端結合反応(※6)による編集)の割合を低減させることが可能となり、正確なゲノム編集が起きた細胞を最大で3倍以上多く得ることが可能になりました。in vivoゲノム編集への応用だけでなく、ex vivoゲノム編集(※7)やゲノム編集を用いた基礎医学研究の際にもスクリーニング効率など研究開発スピードの向上などが見込めます。
本研究成果は、2024年1月23日「Molecular Therapy -Nucleic Acids」オンライン版に掲載されました。
論文タイトル
High-fidelity SpCas9-HF1 enhances accuracy of cell cycle-dependent genome editing by increasing HDR efficiency, and by reducing off-target effects and on-target mutation rates
著 者
松本 大亮1,2、松木 依里奈1、岸 果苗1、井上 雄翔1、濁川 清美1、野村 渉1,2,*
1. 広島大学大学院医系科学研究科 創薬標的分子科学研究室
2. 広島大学薬学部
* 責任著者
掲載雑誌
Molecular Therapy -Nucleic Acids
DOI番号
DOI : 10.1016/j.omtn.2024.102124
この研究成果は科研費、武田科学振興財団、上原記念生命科学財団、内藤記念財団、持田記念医学薬学振興財団などの支援を受けて研究を行い、得られたものです。
ゲノム編集技術は遺伝子を改変、修復する技術として世界中で研究開発が進められています。特定のタンパク質の細胞内産生を抑制する場合(遺伝子ノックアウト(※8))はCRISPR-Cas9を利用して遺伝子のリーディングフレーム(※9)をずらす変異を起こすこと(非相同末端結合反応)で目的を果たせます。しかし、タンパク質に特定の変異を導入して修復したい場合や均一な変異を導入したい場合は細胞外部から変異配列を指定するDNAを同時に導入して、相同組換えが行われる必要があります。しかし、この相同組換えの効率が低いことがゲノム編集技術における今後の課題の一つとなっています。また、標的とする遺伝子配列に類似する配列はゲノム上に多数存在するため、そのような類似配列でも誤った編集が行われる、いわゆるオフターゲット作用(※10)による他のタンパク質への影響や遺伝子機能への影響も懸念されており、これをいかに低減させるか、もゲノム編集の安全性を向上させるためには大きな課題の一つです。これまでに我々の研究室ではCRISPR-Cas9に対して阻害作用をもつAnti-CRISPR(※11)と呼ばれる分子と、細胞周期に応答して発現量が変化するCdt1(※12)という分子をつなげることで、細胞周期によってCRISPR-Cas9の活性が調節される仕組みを構築し、相同組み換えの反応量の増加とオフターゲット作用の抑制を同時に実現する手法を見出しています。
これまでに世界中で単独に低オフターゲット作用を示す高精度Cas9が数種類報告されてきていました。我々が独自に開発してきている細胞周期依存型ゲノム編集技術をこれらの高精度Cas9と組み合わせた場合に、より正確性の高いゲノム編集結果が得られることを期待して研究を行いました。これまでに報告がある高精度タイプのCas9 10種類を用いて検討した結果、SpCas9-HF1と名付けられた高精度タイプCas9を細胞周期依存型ゲノム編集に使用した場合に相同組換え効率の向上に加えて、非相同末端結合によるゲノム編集効率とオフターゲット作用を同時に抑制することが明らかとなりました(図2)。また、研究の過程で検討を行った高精度タイプのCas9のうちのいくつかはCas9と比較して高い相同組換え効率を示すことも明らかになりました。相同組換えによるゲノム編集によって改変される遺伝子配列は反応時に加えるドナー遺伝子に沿った配列になるので高い正確性が担保されます。それと比較して非相同末端結合によるゲノム編集では様々な配列に改変されるため、この反応をいかに抑制するかが、これまでの細胞周期依存型ゲノム編集の手法では課題となっていました。今回、高精度タイプのSpCas9-HF1を使用することでさらに正確なゲノム編集を行うことが可能になったことで、生体内でのゲノム編集などへの応用において有効なツールとなる可能性が期待されます。
世界的には体内でのゲノム編集(in vivoゲノム編集)を遺伝子治療の現場で利用できないかという検証が進んでいます。本手法はゲノム編集活性を細胞が自律的に制御することができる方法が大きな特徴であり、in vivoゲノム編集での活用も期待されます。今後は体内へのゲノム編集ツールの送達方法なども含めた検討を進めていくことになります。また、高精度タイプのCas9が比較的高い相同組換え効率を示すこともこれまで知られていませんでした。今回の発見ではCas9タンパク質の特定の箇所にアミノ酸変異が入っていることによって相同組換え効率に影響を与えている可能性が示されています。この点も理由を探っていくことでこれまでにない高い正確性をもったゲノム編集ツールの開発につなげていくことが可能だと考えています。
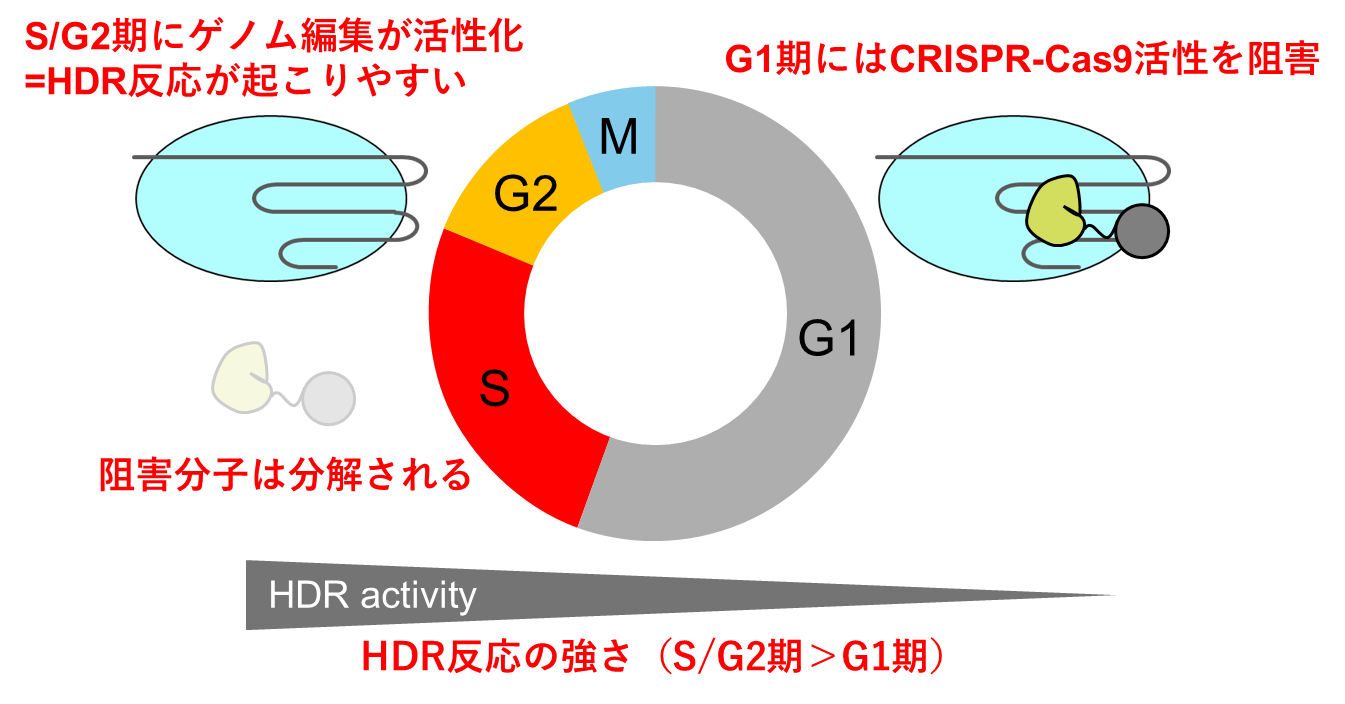
図1. 独自に開発している細胞周期を利用したゲノム編集方法
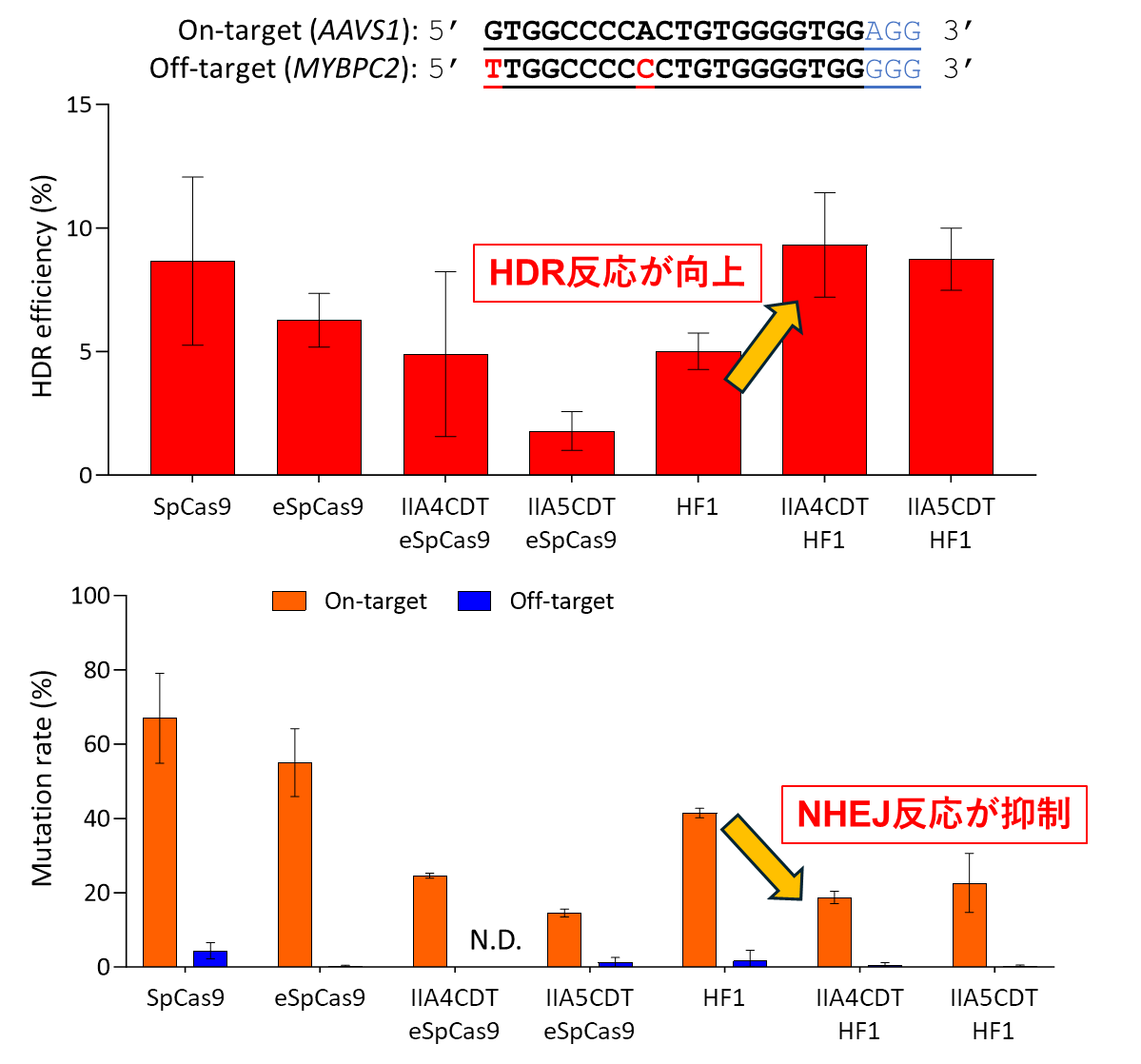
図2. 高精度CRISPR-Cas9との併用でHDR反応の向上とNHEJ反応の抑制が同時に起こる(=正確性が向上)ことが示された実験結果の一例
(※1)細胞周期
細胞が二つの娘細胞を生み出す過程で起こる一連の現象。ゲノムDNAの複製と分配、それに引き続く細胞質分裂がある。細胞周期には4つの決まった順番の期が存在する。これらをG1期,S期,G2期,M期と呼ぶ。
(※2)ゲノム編集
細胞核内にある染色体ゲノム上に存在する遺伝子配列のうち、標的とする配列に対してヌクレアーゼ(DNA切断酵素)を作用させることで切断された遺伝子が改変されることを指す。CRISPR-Casなどがゲノム編集を行うためのツールとなる。
(※3)CRISPR-Cas9
クリスパーキャスと呼ぶ。元々は原核生物における獲得免疫の一つであり、外来遺伝子を切断する機能を持つ。これを応用することで真核生物の遺伝子を切断し、ゲノム編集を行うシステムができた。
(※4)相同組換え
ゲノムDNA上での二本鎖切断の修復で起こる経路の1つであり、非相同組換え経路が切断を接続するだけなのに対して、修復対象の配列に相同なDNA(一部だけ変換したい配列になっている)を鋳型としておくことで外来配列が染色体に組み込まれる。
(※5)in vivoゲノム編集
生体内(in vivo)で直接遺伝子切断反応を行うゲノム編集。mRNAやウイルスを利用した遺伝子/タンパク質の送達技術を利用して標的とする細胞のゲノム編集を行う。
(※6)非相同末端結合
標的遺伝子の切断後に起こる遺伝子修復反応の一つ。この修復を経ることで標的遺伝子部位に数塩基の挿入または欠失が起こり、タンパク質発現などに影響が出る。
(※7)ex vivoゲノム編集
Ex vivoは体外を意味し、造血幹細胞などを生体から取り出し、生体外で細胞にゲノム編集を行う手法のこと。遺伝性血液疾患の治療などに用いられる。
(※8)遺伝子ノックアウト
ある生物に機能欠損型遺伝子を導入する、という遺伝子工学の手法。タンパク質をコードする遺伝子の場合はその発現が完全に抑制される。
(※9)リーディングフレーム
DNAまたはRNA配列をアミノ酸に翻訳する場合の読み取り枠のことを指す。3塩基でアミノ酸配列1個を指定する。読み枠がずれることで読み取りが終了する配列になる。
(※10)オフターゲット作用
ターゲット(標的)とは異なる部位に作用することを指す。遺伝子を対象とする場合は、標的とする遺伝子と似た配列に作用する現象のことを指す。
(※11)Anti-CRISPR
ファージがもつタンパク質で、宿主が持つCRISPR-Casを阻害して宿主細胞内で生存するために使われる。
(※12)Cdt1
細胞周期において、染色体の複製が正確に1回だけ行われることを保証するライセンス化制御因子の1つ。一度複製された染色体が再複製されないように制御する。その発現はG1期に高く,S期ではユビキチン依存的分解により低くなる。
大学院医系科学研究科 教授 野村 渉
Tel:082-257-5308 FAX:082-257-5309
E-mail:wnomura*hiroshima-u.ac.jp
(注: *は半角@に置き換えてください)
掲載日 : 2024年01月30日
Copyright © 2003- 広島大学