<研究に関すること>
広島大学大学院統合生命科学研究科 特任教授 坊農秀雅
Tel:082-424-4013
E-mail:bonohu*hiroshima-u.ac.jp
(注: *は半角@に置き換えてください)

English website is here .
広島大学ゲノム編集イノベーションセンター中前和恭共同研究講座助教(プラチナバイオ株式会社主任研究員)、同大大学院統合生命科学研究科坊農秀雅特任教授は、ゲノム編集の簡易的安全性評価ソフトウェア『DANGER analysis』を開発しました。
ゲノム編集は生物の任意の遺伝情報(ゲノム)にアクセスし、書き換えを行うことが可能な技術として広く利用されています。しかしその一方で、実験設計によっては意図しないゲノムの書き換え(オフターゲット作用)を起こすことも知られています。
本ソフトウェアでは、オフターゲット作用の中でも生物機能へ影響を与えうる作用に着目し、その影響リスクの数値的評価を初めて実現しました。
本研究成果は、イギリスの出版社であるオックスフォード大学出版局と国際計算生物学会(International Society for Computational Biology)が発行するBioinformatics Advances誌に2023年8月23日に掲載されました。
すべての生物の細胞には体の設計図として『ゲノムDNA』という化学物質が含まれています。そしてそのゲノムDNAは、アデニン(A)、グアニン(G)、シトシン(C)、チミン(T) という4つの成分、いわゆる『塩基配列』から構成されています。
ゲノム編集は、ゲノムDNAの任意の塩基配列に『ゲノム編集ツール』と呼ばれる生体分子を作用させて塩基配列の変化を誘導できる技術です。この技術を使ったより安全かつ効率的な品種改良法や、遺伝病の治療方法などが世界中で研究されています。しかし、ゲノム編集には『オフターゲット作用』という問題もあります。これはゲノム編集をしたい塩基配列とは異なる塩基配列へ意図しない変化が起きてしまう現象です。
これまで世界中でオフターゲット作用を検出するさまざまな手法が開発されてきました。その一方で、オフターゲット作用が引き起こす有害な作用を測定する定量的評価手法はまだ開発途上でした(問題1)。また、オフターゲット作用の解析には精度の高いゲノム配列情報が必要ですが、高精度ゲノム配列情報の獲得には高いコストが伴うため、その解析の利用範囲は限定的でした(問題2)。
本研究では、簡易的安全性評価ソフトウェア『DANGER analysis』を開発し、オフターゲット作用の中でも形質(1)に影響を与えうる発現(2)領域上で発生したものに着目し、オフターゲット作用の有害性を数値的に推定する手法を確立しました。
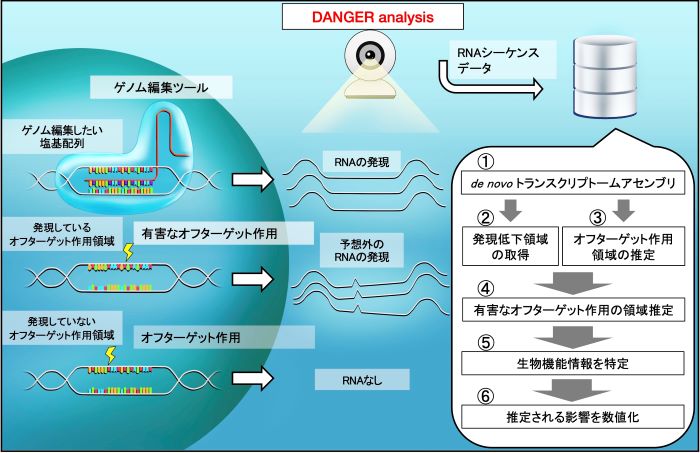
DANGER analysisでは、遺伝子発現実験データであるRNA(3)シーケンスデータからde novoトランスクリプトームアセンブリ(4)と呼ばれる手法で発現領域の塩基配列を解読し、オフターゲット作用の推定ならびに発現解析を行います。そして、影響を受けていると推定される遺伝情報に対して公共バイオデータベースにアクセスし、生物機能情報を取得することで、オフターゲット作用がどのような生体現象に影響を与えている可能性があるか推定します(図1)。
実際に他機関が一般公開したゲノム編集データを本法で解析し、発現領域上の数十から数千のオフターゲット作用が影響を及ぼしている可能性が明らかになりました。
本ソフトウェアは商用利用問わず誰でも無償利用できるコードとしてGitHub上に公開されています(https://github.com/KazukiNakamae/DANGER_analysis)。
本ソフトウェアによって、ゲノム編集においてオフターゲット作用が及ぼす影響を定量的に推定することが可能になります(問題1の解決)。さらにde novoトランスクリプトームアセンブリを利用しているため、高精度なゲノム配列情報なしで簡易的なオフターゲット作用解析が可能です。このため商品作物や患者の細胞でもゲノム編集でのオフターゲット作用の多寡と影響度を発現領域の範囲内で簡単に評価できます(問題2の解決)。また、本ソフトウェアによる解析を予備調査に利用し、高精度ゲノム配列情報を用いた既存のオフターゲット解析法による精査につなげることもできると考えられます。本成果は、世界中の品種改良やゲノム医療の安全性証明法として利用が期待されます。
図1 本ソフトウェア『DANGER analysis』による安全性評価の流れ
オフターゲット作用領域がゲノム編集ツールの作用を受けると予想外のRNA発現が発生する。DANGER analysisでは、①de novoトランスクリプトームアセンブリの構築、②発現低下領域の取得、③オフターゲット作用の推定、④2と3に基づく有害なオフターゲット作用の領域推定、⑤推定された有害なオフターゲット作用領域が属する生物機能情報を特定、⑥生物機能ごとに生体現象に対する影響リスクを数値化、という流れで解析して安全性評価を実施する。
本研究は、日本学術振興会が助成する科学研究費若手研究「パーソナルゲノム治療にむけたPrime Editingゲノム編集データベース構築」(21K17855)、科学技術振興機構(JST)が助成する共創の場形成支援プログラム(COI-NEXT)「Bio-Digital Transformation(バイオDX)産学共創拠点」(JPMJPF2010)によって実施されました。
(1) 形質:生物のもつ性質や特徴のこと全般を指す。遺伝によって子孫に伝えられる形質を特に遺伝形質と呼び、本稿ではこの意味で用語を使用する。
(2) 発現:ゲノムDNA内の遺伝情報が細胞における構造および機能に反映されるプロセスを指す。具体的には、ゲノムDNAの塩基配列に基づいてRNAおよびタンパク質が合成されるプロセスを指す。
(3) RNA:正式名称は「リボ核酸(Ribonucleic acid)』。リボヌクレオチドという物質が一本鎖状に重合した物質。アデニン(A)、グアニン(G)、シトシン(C)、ウラシル(U) という4つの「塩基」から構成されている。細胞内ではゲノムDNAの情報を外部に伝える媒体として合成され、タンパク質はRNAに基づいて合成される。このような利用形態下にあるRNAを特にメッセンジャーRNA(mRNA)と呼称し、本稿ではmRNAと同義の意味でこの用語を使用する。
(4) de novoトランスクリプトームアセンブリ:de novo(デ・ノヴォ)とはラテン語で「初めから」を意味する。既知のゲノム情報を使わず、DNAシーケンサーから出力された配列情報に基づいて発現している領域の塩基配列情報を復元する手法、およびその復元物全体を指す。一般的に生体内に存在するRNAは長く、現在広く使われているDNAシーケンサーでは一度に全体を読むことができないため、解読した塩基配列情報をコンピュータ上でつなげて発現している領域の塩基配列を復元する。
<研究に関すること>
広島大学大学院統合生命科学研究科 特任教授 坊農秀雅
Tel:082-424-4013
E-mail:bonohu*hiroshima-u.ac.jp
(注: *は半角@に置き換えてください)
掲載日 : 2023年09月26日
Copyright © 2003- 広島大学