本研究成果のポイント
- 神経ペプチド受容体VIPR2(※1)が乳癌細胞の遊走に関わることを初めて明らかにし、さらにその制御機構を解明しました。
- 癌細胞遊走は癌転移と密接に関わっていることから、VIPR2が乳癌転移を抑制するための新規治療標的となることが期待されます。
概要
広島大学大学院医系科学研究科細胞分子薬理学 浅野 智志 助教、吾郷 由希夫 教授、大阪大学大学院薬学研究科 橋本 均 教授、一丸ファルコス株式会社 坂元 孝太郎 主席研究員らの研究グループは、乳癌細胞遊走、転移に関わる新規分子として、神経ペプチド受容体VIPR2を見いだしました。
乳癌は、世界的にみても女性で最も罹患数の多い癌です。非浸潤癌が進行して浸潤癌になると活発化し、癌細胞遊走(移動)能や浸潤能が亢進し、血管やリンパ管に入り込み、リンパ節や肺などに転移します。転移能が亢進すると致死率が高くなります。
細胞が移動する時、仮足と呼ばれる細胞の足のような構造体が形成されます。細胞は、人で言うところの「足を踏み出す」ように仮足を伸ばし、その先端は「足の裏」のように地面を掴み、その後残された「体を引き寄せる」ようにして一歩進みます(図1)。この仮足の形成にはホスファチジルイノシトールとよばれるリン脂質の代謝が不可欠で、この代謝に関わる酵素の過剰な活性化は、癌細胞の遊走や転移を亢進させる可能性があります。
神経ペプチド受容体VIPR2は、乳癌を含むいくつかの癌で高発現していることが報告されています。本研究では、VIPR2が神経ペプチドVIPの刺激を受け取ると、仮足形成に関わるリン脂質の代謝酵素が活性化し、仮足の形成、伸長が引き起こされることを明らかにしました。一方、VIPR2機能の阻害は、癌細胞遊走能を低下させました。
今回の結果は、VIPR2が乳癌細胞遊走を制御する重要な分子であることを示していると同時に、VIPR2機能を抑制する化合物が新規の癌転移抑制薬の候補となる可能性を示唆しています。
本研究成果は、2022年9月27日(火)16時(日本時間)にFrontiers in Oncologyに掲載されました。
発表内容
【背景】
細胞遊走は、胚形成、免疫応答、血管新生、創傷治癒、癌転移など、正常な生体機能および病原性のプロセスに関わる進化的に保存された細胞現象です。サイトカインやケモカインなどの特定の細胞外刺激が対応する受容体に結合するとホスファチジルイノシトール 3 キナーゼ (PI3K) (※2)が活性化します。活性化された PI3K は、ホスファチジルイノシトール 3,4,5-三リン酸 [PI(3,4,5)P3]というリン脂質を生成します。PI(3,4,5)P3は仮足の形成や伸長に関与する細胞遊走に必須の脂質であり、また、細胞増殖に関わるAKT(※3)と呼ばれるタンパク質の活性化にも関与しています。
VIPやPACAPとよばれる神経ペプチドの受容体の一つであるVIPR2は、甲状腺癌、胃癌、肺癌、膵臓腺癌、肉腫、および神経内分泌腫瘍での発現が報告されています。VIPR2 mRNAの発現やVIPR2遺伝子のコピー数の増加(※4)が、特に卵巣上皮腫瘍、神経膠芽腫、浸潤性乳癌などで報告されています。
他の研究グループが、乳癌細胞株MCF-7にPACAPを添加した際にAKTが活性化することを報告しており、このことからVIPR2がPI3Kの活性化に関与している可能性が示されていました。しかし、細胞遊走における VIPR2 の役割は分かっていませんでした。
【研究成果の内容】
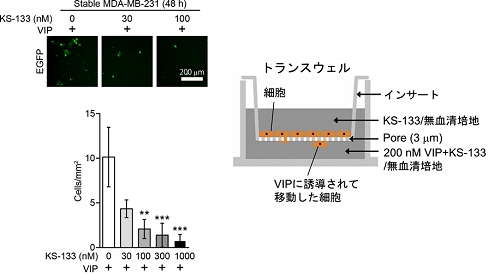
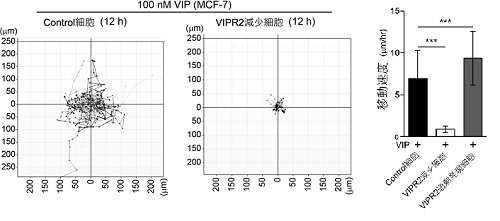
今回、VIPR2やVIPが細胞遊走に関与しているか調べました。 VIPR2の選択的阻害剤KS-133を処置した乳癌細胞MDA-MB-231(図2)、あるいはVIPR2の細胞内発現量を減少させたMCF-7では、細胞遊走が抑制されました(図3)。対照的に、VIPR2 を過剰発現しているMCF-7は、細胞遊走が亢進することがわかりました(図3)。VIPR2やPI(3,4,5)P3は仮足に蓄積しており、VIPR2の発現を減少させるとそれに伴ってPI(3,4,5)P3量が減少し、仮足の伸長が抑制されました。
このように、今回の研究によって、VIP-VIPR2シグナル伝達が、PI(3,4,5)P3 の産生を介して仮足の伸長を調節することにより、癌細胞遊走を制御していることが明らかになりました。
【今後の展開】
今回、VIPR2による乳癌細胞遊走の制御メカニズムが明らかになり、乳癌細胞の遊走能とVIPR2の発現量が相関関係にあることがわかりました。また、最近我々の研究グループが創製したVIPR2に対する選択的な阻害ペプチドKS-133が、実際に癌細胞遊走を抑制できることを示しました(図2)。
今後は、動物モデルを用いてVIPR2阻害剤の効果を検証し、VIPR2を標的とする癌転移の新規治療法の開発研究を進めていきたいと考えています。
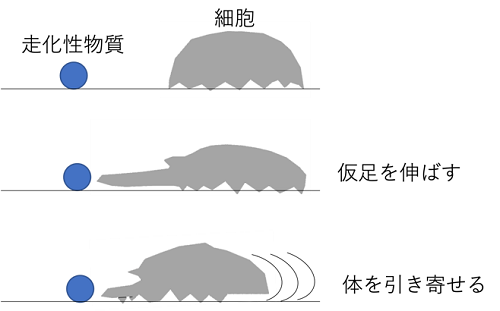
図1 接着細胞の細胞移動。接着細胞は細胞外基質などに接着している。走化性物質の刺激をその特異的受容体が受け取ると、仮足を伸ばし、その後、細胞本体が仮足の方に引き寄せられ、これを繰り返すことで、より高濃度の走化性物質のある方へと移動する。
図2 VIPR2選択的阻害剤KS-133を処置したMDA-MB-231(蛍光タンパク質EGFPを安定発現している)のVIP依存的細胞遊走。右は、実験の模式図。蛍光像の緑の点は移動した細胞を示す。1mm2辺りで移動した細胞の数をグラフに示す。KS-133の濃度依存的に細胞遊走が抑制された。
図3 VIP存在下、12時間で移動した細胞(各30細胞ずつ)の軌跡。1時間ごとに細胞の位置を計測し、12時間に渡り細胞の動きをトレースした。軌跡が長いほど動きが活発であることを示している。VIPR2減少細胞では、細胞遊走が抑制された。この軌跡の長さを基に、細胞の移動速度を算出した。VIPR2をより多く発現している細胞ほど移動速度が上昇した。
用語解説
(※1)神経ペプチド受容体VIPR2
血管作動性腸管ペプチド(vasoactive intestinal peptide:VIP)や下垂体アデニル酸シクラーゼ活性化ポリペプチド(pituitary adenylate cyclase-activating polypeptide:PACAP)とよばれる神経ペプチドの受容体の一つ。VIPやPACAPは、血管拡張作用や免疫機能調節作用といった生理作用に加え、神経保護作用などを有することが知られている。脳においてVIPR2は、概日リズムの調節に関与することが分かっている。PACAPとVIPは3つの異なる受容体、PAC1、VIPR1、VIPR2を異なる親和性で刺激する。これらの受容体は約50%の配列同一性を有している。
(※2)ホスファチジルイノシトール 3 キナーゼ (PI3K)
イノシトールリン脂質のイノシトール環の3位をリン酸化する酵素である。PI、PI4P、PI(4,5)P2を基質として、それぞれPI3P、PI(3,4)P2、PI(3,4,5)P3を生成する。
(※3)AKT
PI3Kのシグナル伝達経路の構成要素であり、Ser473およびThr308のリン酸化によって活性化される、細胞増殖や細胞の生存に関わるタンパク質である。多種類の癌、糖尿病や心臓疾患において、AKTの過剰発現または不適切な活性が報告されている。
(※4)コピー数
常染色体上のゲノムDNAは通常1体細胞当たり2コピーであるが、個々人により1コピー以下しか存在しない領域(欠失)、もしくは3コピー以上存在する領域(重複)があり、コピー数変化あるいはコピー数多型とよぶ。コピー数変化が生じている領域に存在する遺伝子の発現量に影響がみられる。
論文情報
- 掲載誌: Frontiers in Oncology
- 論文タイトル: Vasoactive intestinal peptide-VIPR2 signaling regulates tumor cell migration
- 著者名: 浅野 智志1,2※、山坂 美紗2、小笹 かいり2、坂元 孝太郎3、早田 敦子4,*、中澤 敬信4,#、橋本 均4、Waschek James 5、吾郷 由希夫1,2※ ※ 責任著者
1. 広島大学大学院医系科学研究科細胞分子薬理学
2. 広島大学歯学部
3. 一丸ファルコス株式会社
4. 大阪大学大学院薬学研究科神経薬理学
5. カリフォルニア大学ロサンゼルス校精神医学・生物行動科学部門
*. (現所属)大阪大学大学院歯学研究科薬理学
#. (現所属)東京農業大学生命科学部バイオサイエンス学科
- DOI: 10.3389/fonc.2022.852358
【お問い合わせ先】
<研究に関すること>
広島大学 大学院医系科学研究科 細胞分子薬理学
教授 吾郷 由希夫
Tel:082-257-5640
E-mail:yukioago*hiroshima-u.ac.jp
<報道(広報)に関すること>
広島大学 広報室
Tel:082-424-3701
E-mail:koho*office.hiroshima-u.ac.jp
大阪大学 大学院薬学研究科 庶務係
Tel:06-6879-8144 Fax:06-6879-8154
E-mail:yakugaku-syomu*office.osaka-u.ac.jp
一丸ファルコス株式会社 開発部 坂元孝太郎
Tel:058-320-1017 Fax:058-320-1060
E-mail:sakamoto-kotaro*ichimaru.co.jp
(注: *は半角@に置き換えてください)

 Home
Home