<研究に関すること>
広島大学 両生類研究センター/大学院統合生命科学研究科 教授 荻野 肇
TEL:082-424-7482
E-mail:oginohaji*hiroshima-u.ac.jp
<報道に関すること>
■広島大学 広報室
TEL:082-424-3701
E-mail:koho*office.hiroshima-u.ac.jp
(注: *は半角@に置き換えてください)
山形大学医学部の越智陽城准教授と広島大学両生類センターの荻野肇教授らの共同研究グループは、東京大学の金井昭教特任准教授・鈴木穣教授の 文部科学省 科学研究費助成事業、学術変革領域研究「学術研究支援基盤形成」先進ゲノム支援を受け、両生類をモデルに腎尿細管が再生する仕組みの解明とその再生を促進する薬剤を発見しました。
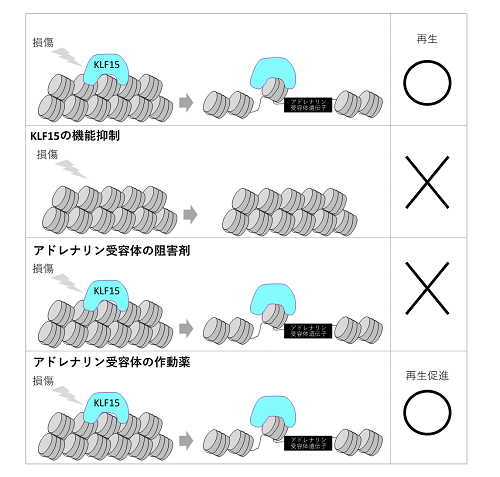
本研究グループは、腎尿細管再生のメカニズムを探るために、両生類の腎尿細管細胞を使い網羅的オープンクロマチン解析用語2・エピジェネティック修飾用語3のクロマチン免疫沈降シーケンス解析用語4・網羅的発現解析用語5を行いました。すると、損傷後の再生過程でオープンになるクロマチン領域にはKLF15が結合すること、その標的遺伝子の1つアドレナリン受容体の働きを阻害すると再生が起こらないことを発見しました。さらに損傷を与えた腎尿細管にアドレナリン受容体の作動薬を作用させると、再生が促進されることを見出しました。
以上の結果は、未解明だった損傷後の腎尿細管が再生に至るまでのメカニズムの一端が明らかになったことに加え、そのメカニズムに作用する薬剤を用いることで再生の促進が可能あることを示すものであり、ヒトにおける再生促進に貢献すると期待されます。
本成果は、2022 年 8 月 8 日(現地時刻)に米国の国際学術誌「Proceedings of the National Academy of Sciences of the United States of America (Proc. Natl. Acad. Sci. U. S. A.) (米国科学アカデミー紀要)」にオンライン掲載されました。
【研究の背景】
損傷を受けた組織が再生するとき、再生に働く遺伝子を発現します。これら再生遺伝子の多くは、組織や器官形成で使われた発生制御遺伝子用語6であることが知られています。発生制御遺伝子は、組織や器官が完成すると使う必要がなくクロマチン用語7が閉じられ発現が抑制された状態になります。損傷後に遺伝子を再発現させるためには、まずはクロマチンを開くことが必要ですが、そのメカニズムはわかっていませんでした。ヒトを含む哺乳類の腎尿再開の再生では、尿細管上皮細胞のなかに分裂速度の遅い細胞があり、それらが損傷尿細管の再生の源であることが知られています。両生類は哺乳類とよく似たシステムを採用しており、腎尿細管が損傷を受けると、残っている尿細管上皮細胞の一部を使い再生します。そこで本研究は両生類をモデルに、網羅的オープンクロマチン解析を足掛かりとして、腎尿細管の再生メカニズムの解明を行いました。
【研究の成果】
両生類胚の腎尿細管の損傷前、再生中、再生が完了した細胞を用いて、網羅的オープンクロマチン解析、エピジェネティク修飾免疫沈降シーケンス解析、全RNA発現解析を行いました。これらデータを統合的に解析し、再生時にクロマチンが開く領域をエンハンサー用語8の候補として、そのエンハンサーの活性化因子の候補としてKLF、標的遺伝子の候補としてアドレナリン受容体(Adra1a)を発見しました。転写因子KLFは、山中4因子の1つとして知られていますが、この転写因子ファミリーは活性化因子型、抑制因子型、活性化と抑制の両方の機能を持つ二機能型があります。全RNA発現解析から再生中の腎尿再開細胞では、KLFファミリーのなかでも、klf4、 klf6、klf15、sp1、sp4が発現することがわかりました。そこで次にいずれのKLFが再生特異的なオープンクロマチン領域(エンハンサーの候補)に対する転写活性化能を持つのか調べたところ、Klf6とKlf15が活性化因子として働くことがわかりました。次に、再生特異的なオープンクロマチン領域が腎損傷後の再生エンハンサーとして働くのか調べるために両生類のトランスジェニック・レポーター解析用語9を行ったところ、再生特異的なオープンクロマチン領域は腎尿細管の損傷に応答して活性化するエンハンサーであることがわかりました。
また、KLF15の機能を抑制すると腎尿細管の再生が阻害されることもわかりました。KLF15は沢山の遺伝子の発現を誘導しますが、その1つにアドレナリン受容体があります。アドレナリン受容体はKLF15の制御下で再生遺伝子として働くことが予想されます。そこで、腎尿細管に損傷を与えた両生類胚に対してアドレナリン受容体の阻害剤をさせると、その再生が抑制されることがわかりました。また反対にアドレナリン受容体の作動薬をさせると、腎尿細管の再生が促進されることがわかりました。
【今後の展開】
ヒトを含む哺乳類では、尿細管上皮細胞の一部の細胞が損傷後の再生に寄与することが知られています。両生類も哺乳類とよく似たシステムを採用しており、腎尿細管が損傷を受けると、残っている尿細管上皮細胞の一部を使い再生します。このことはヒトも本研究で発見した再生メカニズムを使っている可能性があります。KLF15-アドレナリン受容体を標的とした医薬シーズ開発を実施することで、ヒトにおける損傷治癒を促進させる技術や医薬品の開発に繋がることが期待されます。
[用語1] 転写因子はエンハンサーなどのDNA配列に結合するタンパク質で、遺伝子の発現のオン・オフを決定する因子である。KLF15は山中4因子の1つKLF4も属するZnフィンガー型転写因子 Krüppellike factor family of transcription factor (KLF)ファミリーに属する。
[用語2] 網羅的オープンクロマチン解析(ATAC-seq)はトランスポゼースを使い、クロマチンがオープンになっている領域を次世代シーケンサー(DNA配列を大量に読み取る装置)で網羅的に解析する技術である。全ゲノムレベルでエンハンサーやプロモーター領域を解析する方法として利用される。
[用語3] エピジェネティック修飾: 後天的にゲノム機能を制御する情報。DNAの塩基配列の変化を伴わず、DNAそのものやDNAが絡みついているヒストンタンパク質の修飾などにより、遺伝子の発現が制御される。
[用語4] クロマチン免疫沈降シーケンス解析(ChIP-seq解析): 目的とするヒストンタンパク質のエピジェネティック修飾に対する抗体を用いてタンパク質を含む断片を濃縮し、DNAの配列を次世代シーケンサで解析することによりヒストン修飾状態を全ゲノム的に得るエピゲノム解析手法。
[用語5] 網羅的発現解析(RNA-seq解析): 細胞内の全遺伝子発現レベルを次世代シーケンサで計測する手法。
[用語6] 発生制御遺伝子: 組織や器官の形成に関わる遺伝子。
[用語7] クロマチン: ゲノムDNAとヒストンなどのタンパク質の複合体で、DNAが折りたたまれている。この構造変化により転写因子のDNAへの結合が調整されることで遺伝子発現が制御される。
[用語8] エンハンサー: ゲノムの中には遺伝子の他に、非コードDNA領域と呼ばれる遺伝子以外の領域が存在する。この非コードDNA領域はヒトゲノムの98%を占め、遺伝子の発現をオンにしたり、オフにしたりする領域が存在する。遺伝子の発現をオンにする領域は、エンハンサーと呼ばれる。脊椎動物の間で比べると、遺伝子の総数やその機能は、よく似ていることが知られている。このことから、非コードDNA領域のエンハンサーなどの働きが、生命の鍵を握るといわれている。
[用語9] トランスジェニック・レポーター解析: ヒトゲノムには約2万個の遺伝子が存在すると言われている。一方、それら遺伝子を発現させるためのエンハンサーは、100万個程度あると予想されている。体の中でのエンハンサーの働きを知るために、エンハンサーと予想されるゲノム領域をgreen fluorescent protein(GFP)などの蛍光タンパク質遺伝子に連結した人工遺伝子 (レポーターと呼ばれる)を作製し、これを遺伝子改変技術でゲノムに導入する方法がある。これを、トランスジェニック・レポーター解析という。
<研究に関すること>
広島大学 両生類研究センター/大学院統合生命科学研究科 教授 荻野 肇
TEL:082-424-7482
E-mail:oginohaji*hiroshima-u.ac.jp
<報道に関すること>
■広島大学 広報室
TEL:082-424-3701
E-mail:koho*office.hiroshima-u.ac.jp
(注: *は半角@に置き換えてください)
掲載日 : 2022年08月22日
Copyright © 2003- 広島大学