発表のポイント
- コアフコシル化を減少させたマウスは血清中の免疫グロブリンIgG濃度が有意に低下する。一方で、L-フコースの経口投与によりコアフコシル化を増加させると、IgGの濃度が上昇する。
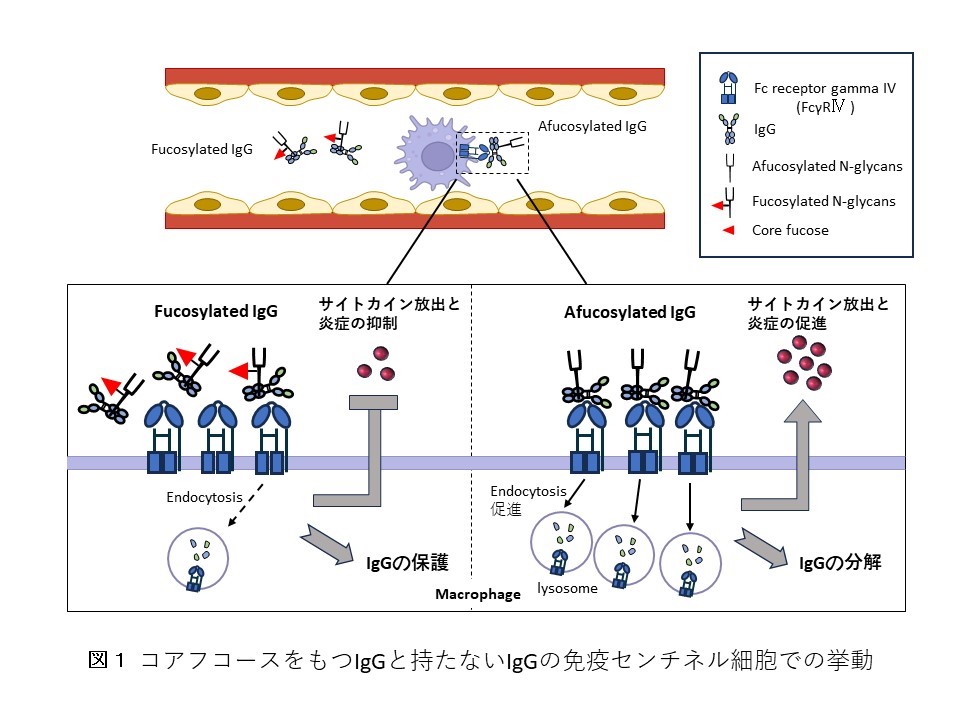
- コアフコースを持たないIgG(Afucosylated IgG)のFc領域はマクロファージや好中球など免疫センチネル細胞に発現するFc受容体であるFcγRⅣとの結合が強くなり、IgGの分解が促進される(図1)。Fc-FcγRⅣの結合により炎症サイトカインの放出が促進されるが、L-フコース投与でそれが抑制される。
- 糖鎖による血清IgGの安定化は慢性炎症や免疫療法の有効な治療法となる可能性がある。
概要
東北医科薬科大学 分子生体膜研究所の顧建国 教授、広島大学大学院 統合生命科学研究科 中ノ三弥子 准教授らの研究グループは、糖転移酵素のひとつであるFut8*1によるIgGの安定化(⾎中滞留性の向上)とその仕組みを明らかにしました。
また、広く生物界に分布している糖の一種であるL-フコース*2がIgGの⾎中滞留性を向上させる化合物であることを明らかにしました。これまで、IgGのコアフコシル化は抗体依存性細胞傷害(ADCC)*3活性に注目があつまって来ましたが、本研究結果は、コアフコシル化によるIgG の安定性促進という新しい概念を提案するもので、L-フコースを用いた、医療用抗体の血中半減期の制御やCOVID-19感染の重症患者に見られたcytokine stormを抑制戦略などにつながることが期待されます。なお、この研究成果は米国の科学雑誌The Journal of Biological Chemistry (JBC)に2024年7月11日付で公開されました。
研究背景と内容
免疫グロブリンG(IgG)は、免疫応答の主要分子です。これまでの研究によって、IgG上の糖鎖構造の違いは、IgGの機能(質)に大きな影響を与えることが明らかになっています。N型糖鎖*4は、IgGの最も一般的な修飾で、その多くがコアフコシル化*1されています。α1,6-フコシルトランスフェラーゼ(Fut8)によって触媒されるコアフコシル化はFc受容体(FcγR)*5のN型糖鎖とIgGのN型糖鎖の相互作用を妨げ、FcγRIIIa(マウスのFcγRⅣの相当)に対する結合親和性を大きく低下させています。このため、コアフコシル化されていないIgGは、ADCC活性が著しく上昇します。このようにIgGのコアフコシル化は、抗体治療・ワクチン・免疫療法の有効性などに重要な意味を持ちます。しかし、抗体(薬)の効果は機能だけでなく、(発現)量や半減期の長さ(安定性)も重要です。
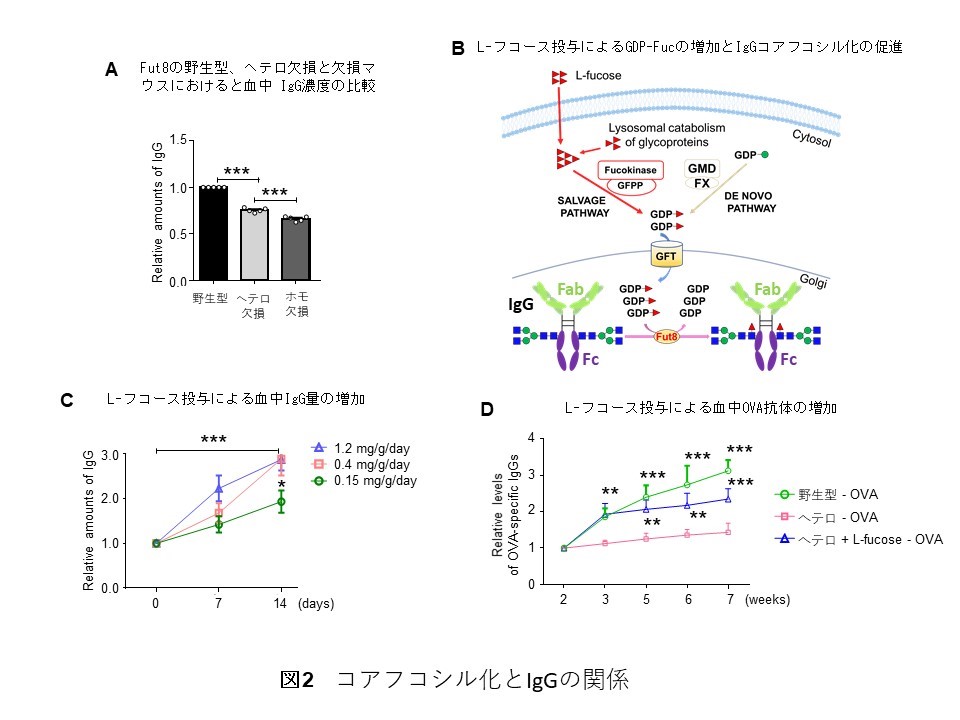
これまで、脳神経炎症におけるFut8発現の重要性を明らかにしてきました。本研究では、Fut8欠損マウスやFut8ヘテロ欠損*6マウスは野生型マウスと比較してIgG量が低下していることを見つけました(図2A)ので、コアフコシル化が血清IgGの量を変化させるメカニズムを検討しました。先天性糖鎖形成異常症に対する糖鎖補充療法を参考に、L-フコースをFut8ヘテロ欠損マウスに経口投与し、コアフコシル化が促進させる(図2B)と、IgG量が回復しました(図2C)。しかし、コアフコシル化IgGと総IgGの比率には有意差が見られず、mRNAの発現量にも変化がありませでした。
Fut8ヘテロ欠損マウスのIgG量の低下はIgGの転写変化とは関係がないようなので、次にIgGの安定性(⾎中滞留性)に注目しました。IgGはFc受容体を高発現するマクロファージや好中球などの免疫センチネル細胞にエンドサイトーシスによって取り込まれ、リソソームへ送られて分解されます。興味深いことに、Fut8ヘテロ欠損マウスでFcγRⅣの発現が有意に高くなっていますが、L-フコース投与でFcγRⅣの発現が低下しました。IgGのエンドサイトーシスにおけるFcγRⅣ発現の重要性やIgGコアフコシル化の有無による違いは、ミクログリア由来細胞株BV2細胞を用いてinvitroでも確認しました。一方、L-フコースの投与は、IgGの保護作用を有する胎児性Fc受容体(FcRn)の発現に影響を与えませんでした。これらの結果は、血中IgG濃度が主にIgGのコアフコシル化のレベルによるFc-FcγRⅣ分解経路を介して調節されていることを示唆しています。
さらに、抗原刺激に対する抗体産生量を検討しました。卵白に含まれる主要なタンパク質であるオボアルブミン(OVA)を抗原としてマウスに免疫し、OVA抗原を認識するIgGの量を測定したところ、野生型マウスよりFut8ヘテロ欠損マウスのIgG量が明らかに低値を示しました。しかし、Fut8ヘテロ欠損マウスにL-フコースを投与することでIgGの量が投与量依存的に増加しました(図2D)。
これらの知見は、IgG安定性を調節するという新しい概念(図1)を提案するもので、L-フコースが免疫療法の有効な薬剤であることを示しています。
成果の意義
現在、がんや自己免疫疾患などに関連する抗体医薬品が多く開発されています。抗体医薬品は一般的に血中半減期が数日〜数週間程度で、延長することが出来れば、その効果も大きくなることが期待されます。また、過度のエンドサイトーシスと分解を抑制することは、COVID-19感染の重症患者に見られたcytokine stormを抑えることにもつながります。今回明らかにしたL-フコース投与という副作用の少ない方法での、IgGの⾎中滞留性の向上は抗体医薬品の治療戦略に貢献することが期待されます。
本研究は、JSPS科研費23K27133, 22K19443, 22K06615, 21K06547および共同利用・共同研究拠点として文部科学大臣認定を受けた糖鎖生命科学連携ネットワーク型拠点(J-GlycoNet)における戦略的融合研究として、ヒューマングライコームプロジェクト(Human Glycome Atlas Project(HGA))を推進する共同研究として実施されました。
用語説明
*1. Fut8・コアフコース:コアフコースはN型糖鎖の還元末端に存在するフコースです。哺乳動物では、コアフコース糖鎖はα1,6フコースだけを指し、付加できるのはフコース転移酵素の中でもFut8だけです。コアフコース糖鎖には様々な生理活性がありますが、がん・炎症との関係が注目されている糖鎖構造です。
*2. L-フコース:天然に存在する六炭糖の一つで、6-デオキシ-ガラクトースとも呼ばれています。マウスにL-フコースを経口投与して、Fut8のドナー基質である GDP-フコースの合成経路のうち、salvage経路を活性化するとコアフコースが増加します。
*3. 抗体依存性細胞傷害(ADCC):NK細胞等のエフェクター細胞を介した抗体依存性細胞障害活性は、IgGとFcγRⅢa*5との結合を高めることで増強されます。IgGのコアフコシル化を抑制する事でADCC活性を飛躍的に高まることを利用したコアフコース非修飾抗体が、がんや自己免疫疾患に対する医薬品として、既に臨床応用されています。
*4. 糖鎖・N型糖鎖: 糖鎖は単糖が鎖のようにつながったもので、たんぱく質や脂質と結合して細胞の表面を覆っています。糖鎖がタンパク質に結合する様式は2通りありますが、アスパラギンの側鎖に結合するのがN型糖鎖です。N型糖鎖は様々な膜受容体の機能を調節していることが知られています。
*5. FcγR :IgGのFc部位に対する受容体タンパク質(Fcγ受容体)で、 IgGにより捕捉された抗原分子の細胞内取り込みに働き、液性免疫応答をエフェクター細胞に伝達します。FcγRⅣはヒトFcγRⅢaのオーソログで、抗体機能をマウスで薬理評価する際に重要なFc受容体分子です。
*6. Fut8ヘテロ欠損マウス:ヒトやマウスは各遺伝子を2つ持っています。ある遺伝子の片方を欠いた状態のものをヘテロ欠損マウスと呼びます。Fut8ヘテロ欠損マウスはFut8遺伝子が片方だけのマウスで、体内でコアフコース糖鎖をつくる活性が減少しています。
論文名
タイトル:Core fucosylation within the Fc-FcγR degradation pathway promotes enhanced IgG levels via exogenous L-fucose
著 者:Yuhan Sun1, Xing Xu1, Tiangui Wu1, Tomohiko Fukuda1, Tomoya Isaji 1, Sayaka Morii2, Miyako Nakano 2, and Jianguo Gu1
著者所属:1東北医薬大・分生研・細胞制御; 2広大院・統合生命科学
DOI:10.1016/j.jbc.2024.107558
【お問い合わせ先】
【本件に関するお問い合わせ先】
東北医科薬科大学 薬学研究科
細胞制御学教室
教授 顧 建国(グ チェゴ)
TEL:022-727-0216 (直通)
E-mail:jgu*tohoku-mpu.ac.jp
広島大学大学院 統合生命科学研究科
生物工学プログラム
准教授 中ノ 三弥子(ナカノ ミヤコ)
TEL:082-424-4539 (直通)
E-mail: minakano*hiroshima-u.ac.jp
(取材に関すること)
東北医科薬科大学 入試・広報課
担当:片岡(かたおか)
TEL:022-727-0363(直通)
E-mail:koho*tohoku-mpu.ac.jp
広島大学 広報室
TEL:082-424-6762(直通)
E-mail:koho*office.hiroshima-u.ac.jp
大学HP:https://www.hiroshima-u.ac.jp/
(*は半角@に置き換えてください)

 Home
Home





