広島大学大学院統合生命科学研究科 生命医科学プログラム
細胞生物学研究室
教授 千原 崇裕
Tel:082-424-7443 FAX:082-424-0793
E-mail:tchihara*hiroshima-u.ac.jp
(注: *は半角@に置き換えてください)
本研究成果のポイント
- 生体膜(細胞膜や小胞体膜)に刺さり、細胞小器官の「繋ぎ止め分子」として働くタンパク質(ショウジョウバエVap33)は、通常時、その一部(MSPドメイン側)を細胞質側に向けている。
- ショウジョウバエVap33が細胞膜へ輸送される際に、膜に刺さる向きを逆転させ、その一部(MSPドメイン)を細胞外に露出させるケースがあることを発見した。そして、細胞外に露出したVap33 MSPドメインは切断酵素Mmp1/2によって切断され、結果的にMSPドメインが細胞外に分泌されることが判明した。(図4参照)
- ヒトVAPB(ショウジョウバエVap33に相当)は筋萎縮性側索硬化症(ALS8)(注1)の原因因子として知られており、ALS患者の脳脊髄液ではMSPドメイン量が減少している。本研究成果は、細胞内のMSPドメインが細胞外へ分泌されるメカニズムの一端を明らかにするもので、ALS治療戦略考案の一助になることが期待される。
概要
広島大学大学院統合生命科学研究科の亀村興輔研究員、千原崇裕教授らの研究グループは、小胞体膜タンパク質(注2, 3)であるショウジョウバエVap33(ヒトVAPBタンパク質に相当)が細胞膜まで運ばれる過程で、そのトポロジー(膜への挿入方向、図1)を逆転させていることを見出しました。更にトポロジー逆転の結果、Vap33は細胞膜上で切断されるようになり、Vap33の一部(MSPドメイン)が細胞外に分泌されることも明らかにしました。
ヒトVAPBは、筋萎縮性側索硬化症(ALS8)の原因因子として知られており、ALS患者の脳脊髄液ではMSPドメイン量が減少しています。本研究成果は、細胞内の小胞体タンパク質VAPB MSPドメインが細胞外へ分泌されるメカニズムの一端を明らかにするもので、ALS治療戦略考案の一助になることが期待されます。
本研究は、米国ジョージア大学の神山大地准教授、旭川医科大学の甲賀大輔准教授、鹿児島大学の久住聡助教、東北大学の関根清薫助教との共同研究による成果であり、国際科学雑誌「Nature Communications」に10月10日付でオンライン掲載されました。
論文情報
掲載雑誌名:Nature Communications
論文名:Secretion of endoplasmic reticulum protein VAPB/ALS8 requires topological inversion
著者名:Kosuke Kamemura, Rio Kozono, Mizuki Tando, Misako Okumura, Daisuke Koga, Satoshi Kusumi, Kanako Tamai, Aoi Okumura, Sayaka Sekine, Daichi Kamiyama & Takahiro Chihara
DOI:https://doi.org/10.1038/s41467-024-53097-5
掲載日時:2024 Oct 10
背景
細胞内の細胞小器官(注4)がその形や機能を維持するためには、それぞれ小胞体に「接触」する必要があり、その「繋ぎ止め分子」として機能するのがVAPBと呼ばれる小胞体膜タンパク質です(図2)。VAPBは筋萎縮性側索硬化症(ALS8)の原因遺伝子であることが知られています。近年、VAPBのMSPドメインが切断・分泌され、他の細胞の様々な受容体に結合することで、細胞外へのシグナル伝達分子(注5)として機能することが分かってきました(図3)。さらに孤発性ALS患者(注1)の脳脊髄液では、MSPタンパク質が顕著に減少していることから、VAPB MSPドメインの分泌機構に注目が集まっていましたが、その仕組みはよく分かっていませんでした。本研究では、VAPB MSPドメインがどのようにして細胞外に分泌されるのか、そのメカニズムの解明に取り組みました。
研究成果の内容
本研究では、遺伝学的解析に優れたショウジョウバエのVap33(ヒトVAPBに相当するショウジョウバエのタンパク質)を用いて、そのMSPドメインの分泌メカニズムの解明を目指しました。まず、生化学的手法・免疫電子顕微鏡法を用いて、小胞体膜上のVap33は、MSPドメインを細胞質側に向けていることを確認しました(図4)。これは、これまでVap33が細胞小器官繋ぎ止め分子として研究されてきた事実とも合致します。通常、小胞体膜タンパク質の細胞質側に面するドメインは、細胞膜へ輸送された後も細胞質側、すなわち細胞の内側に面することが知られています。しかし私達は、Vap33が小胞体から細胞膜へ移動する過程で、そのMSPドメインを細胞外に露出させている、すなわちトポロジーを逆転させていることを発見しました。一般に、細胞膜に挿入された膜タンパク質は、そのトポロジー状態を変化させることはありません。よって今回のVap33のトポロジーが逆転するという結果は大きな驚きでした。さらに解析を進めることで、トポロジーを逆転させたVap33は、細胞膜上で細胞外プロテアーゼMmp1/2によって切断されることで、結果的にMSPドメインを細胞外に放出していることも分かりました。
今後の展開
本研究を通して、VAPB/Vap33は小胞体から細胞膜まで輸送される過程でそのトポロジーを逆転させ、その後Mmp1/2プロテアーゼによる切断を受けることで結果的にMSPドメインが分泌されることを明らかにしました(図4)。今後、細胞膜上VAPB/Vap33のトポロジー状態や、Mmp1/2の活性を調節することでMSPドメインの細胞外への分泌を制御することが可能になると考えられます。またこの発見は、ALS病態理解さらには新しい治療戦略考案にもつながる成果として期待されています。
用語解説
(注1)筋萎縮性側索硬化症(ALS):手足・のど・舌の筋肉や呼吸に必要な筋肉が徐々にやせて力がなくなっていく病気。家族性と孤発性があり、孤発性は遺伝しない。
(注2)小胞体:細胞内細胞質中にある網目状で扁平な袋状の膜構造が幾重にも折り重なったような細胞小器官。細胞内の物質輸送の機能をもつ。
(注3)膜タンパク質:動植物すべての細胞や細胞小器官の膜の中で働くタンパク質の総称
(注4)細胞小器官 : 細胞内にあって、一定の機能を持つ小器官の総称。核、ミトコンドリア、ゴルジ体などが例として挙げられる。
(注5)シグナル伝達:細胞によって、ある種のシグナル(情報)が他の種類のシグナルに変換される過程。一般的に、細胞膜上の受容体に、ホルモンなどの細胞外シグナル分子が結合することで始まる。
図1 膜タンパク質のトポロジー
膜タンパク質のトポロジーとは、膜タンパク質が生体膜に組み込まれる向きのことをいう。具体的には、N末端とC末端が生体膜に対して細胞外(もしくは細胞小器官の内側)と細胞質のどちら側を向いているかを指す。膜タンパク質が正常な機能を果たすためには、生体膜上で一定のトポロジーを取ることが重要である。
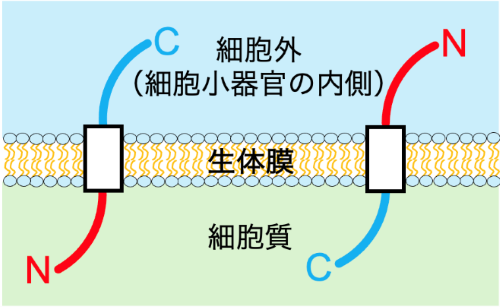
図2 VAPBは小胞体とその他の細胞小器官の「繋ぎ止め分子」として働く。
赤い四角形は、細胞小器官と小胞体の接触場におけるVAPBを示す。VAPBは、ミトコンドリア・エンドソーム・ペルオキシソーム・脂肪滴・ゴルジ体・細胞膜などの多様な細胞小器官を小胞体膜に繋ぎ止め、それらの構造や機能を維持している。
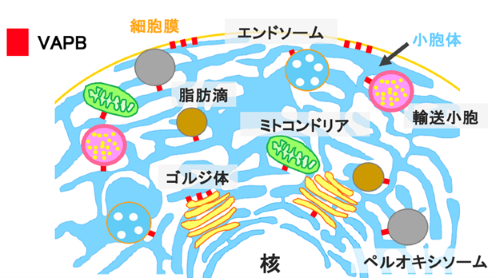
図3 VAPBは切断・分泌され、細胞外シグナル伝達分子としても機能する
分泌されたMSPドメインは細胞膜上に存在する様々な受容体(Eph, Robo, Lar)に結合する。VAPBの細胞外機能と分泌メカニズムに関しては、研究があまり進んでいない。
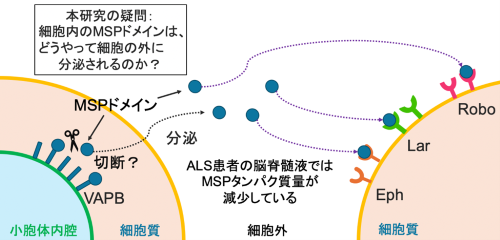
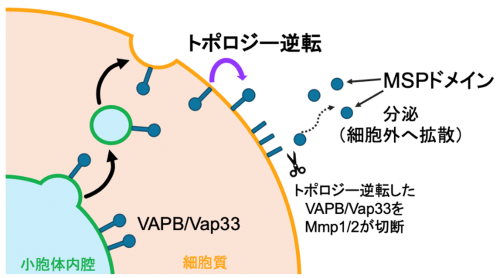
図4 VAPB/Vap33 MSPドメインの分泌モデル
VAPB/Vap33は膜にアンカーされた状態で細胞膜まで輸送される。その過程で、トポロジー逆転によりMSPドメインを細胞外に向け、Mmp1/2によってMSPドメインが切断・分泌される。

 Home
Home



