岡田 賢(おかだ さとし)
広島大学大学院医系科学研究科 小児科学 教授
TEL: 082-257-5212
E-mail: sokada*hiroshima-u.ac.jp
(注: *は半角@に置き換えてください)
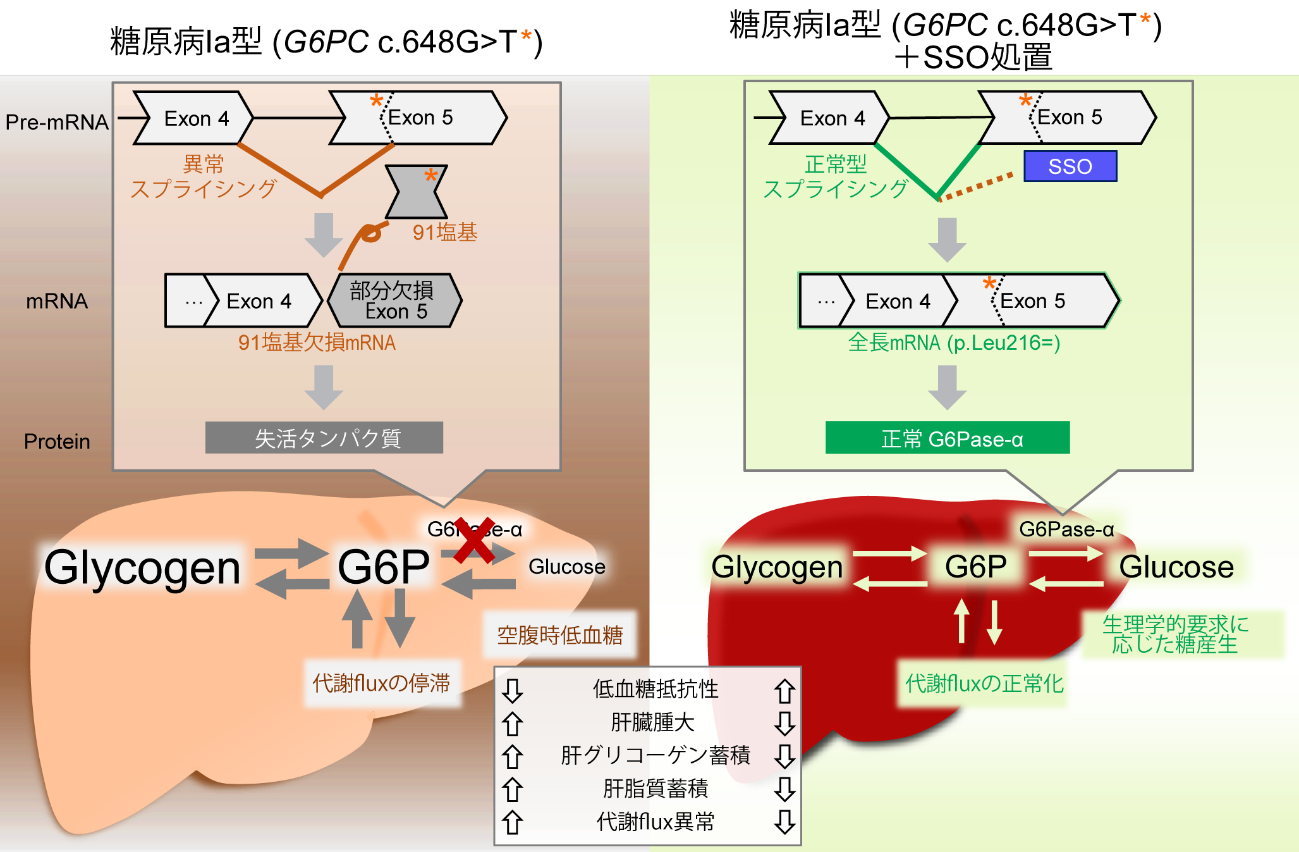
・糖原病Ia型は、グルコース6リン酸脱リン酸酵素(G6Pase-α、遺伝子名:G6PC)の機能欠損変異により、低血糖や肝腫大、腎障害を示す先天性の代謝異常症です。現在、食事療法を中心とした血糖管理がされていますが、肝腫大が肝腺腫に発展する症例も少なくなく新規治療法が求められています。
・今回、異常スプライシングによりG6Pase活性を失う糖原病Ia型の東アジア好発変異G6PC c.648G>Tに対し、この異常スプライシングの是正を意図した核酸医薬(DS-4108b)を設計しました。DS-4108bは、G6PC c.648G>Tを発現するヒト細胞およびモデルマウスにおいて異常スプライシングの是正およびG6Pase活性の回復を示し、モデルマウスの低血糖のみならず肝臓代謝および肝腫大等を改善しました。またマウス及びサルを用いた薬物動態及び安全性試験において、DS-4108bは良好なプロファイルを示しました。
・これらの結果からDS-4108bは、月一回程度の投与頻度で空腹時の急峻な血糖低下を予防し、肝腫大等の従来治療介入困難だった症状を改善することが示唆されました。本研究で開発したスプライシングを是正する核酸は、G6PC c.648G>Tを有する糖原病Ia型患者に対する新規治療の候補として期待されます。
広島大学大学院医系科学研究科の伊藤健太郎研究員(指導教員:岡田賢教授、現・第一三共株式会社)、岡田賢教授らのグループは、核酸医薬による糖原病Ia型の治療可能性をヒト細胞及び病態モデル動物を用いて示しました。本研究は第一三共株式会社 高石巨澄主席ら、国立成育医療研究センター 但馬剛室長(兼 広島大学医学部 客員准教授)、中村秀文主幹、神戸学院大学(研究当時、現・神戸常盤大学) 松尾雅文特命教授との共同研究の成果です。今回得られた知見は、糖原病Ia型の新規治療法の発展に貢献すると期待されます。
本研究成果は、国際学術雑誌『Journal of Clinical Investigation』オンライン版に12 月 1 日に掲載されました。
論文名:A splice-switching oligonucleotide treatment ameliorates glycogen storage disease type 1a in mice with G6PC c.648G>T
著者名:Kentaro Ito1, 2, Go Tajima1, 3, Chikako Kamisato2, Miyuki Tsumura1, Mitsuhiro Iwamoto2, Yukiko Sekiguchi2, Yukinobu Numata2, Kyoko Watanabe2, Yoshiyuki Yabe2, Satomi Kanki2, Yusuke Fujieda2, Koichi Goto2, Yoshitaka Sogawa2, Masataka Oitate2, Hiroyuki Nagase2, Shinnosuke Tsuji2, Tomohiro Nishizawa2, Masayo Kakuta2, Takeshi Masuda2, Yoshiyuki Onishi2, Makoto Koizumi2, Hidefumi Nakamura3, Satoshi Okada1, Masafumi Matsuo4, Kiyosumi Takaishi2*
1:広島大学大学院 医系科学研究科
2:第一三共株式会社
3:国立成育医療研究センター
4:神戸学院大学
*:責任著者
掲載雑誌名:Journal of Clinical Investigation
DOI: 10.1172/JCI163464
糖原病Ia型は、肝臓・腎臓に主に発現するグルコース6リン酸脱リン酸酵素(G6Pase-α、遺伝子名:G6PC)が遺伝子変異による機能欠損することで、低血糖やグリコーゲン蓄積による肝腫大・腎障害を示す常染色体潜性遺伝の代謝異常症です。低血糖発作を予防するため、夜間も含めた食事療法(数時間毎のコーンスターチ摂取や特殊ミルクの頻回摂取)の導入により予後は改善しましたが、低血糖に対する不安と食事管理に関する患者家族の負担は大きい上、肝腫大・肝腺腫を始め管理困難な症状は少なくありません。現在、本症に対する治療開発として、AAV遺伝子治療やmRNA治療の臨床試験が行われています。しかし、AAV遺伝子治療は現状複数回投与ができないために有効期間が限られること、mRNA治療は頻回静脈注射が必要かつ投与間の血糖値管理が煩雑であることが懸念されており、治療介入困難な症状を改善し、かつ長期間安定的な疾患管理を可能にする薬剤が求められています。
糖原病Ia型を引き起こすG6PCの遺伝子変異は人種毎に好発変異があり、c.648G>Tは東アジア(日本、韓国、中国)の患者の大半で検出され、エクソン5の先頭91塩基が欠失する異常スプライシングによりG6Pase機能欠損を呈する変異です。この変異はアミノ酸置換を伴わない(p.Leu216=)ため、異常スプライシングが是正されれば正常G6Paseに翻訳され、糖原病Ia型の様々な症状の改善が期待できます。近年、スプライシングを制御する技術としてスプライススイッチングオリゴヌクレオチド(SSO)療法が注目されています。SSOは、pre-mRNAに結合し代替スプライシングを誘導することで機能的なタンパクを産生するアンチセンスで、既にデュシェンヌ型筋ジストロフィーや脊髄性筋萎縮症などを対象とした複数のSSOが薬事承認されています。またアンチセンスは、肝臓に長期間安定局在を可能にする化学修飾や送達技術が臨床で実証されるまでに進展します。以上を踏まえ、糖原病Ia型の新たな治療法としてG6PC c.648G>Tに対するSSO療法の可能性を検討しました。
G6PC c.648G>Tの異常スプライシングを是正可能かつ肝臓で長期間安定局在可能な化学修飾を付与したSSOとしてDS-4108bをデザインしました。G6PC c.648G>T発現ヒト細胞および新規に作出したG6PC c.648G>T薬剤誘導型ノックイン(cKI-Mut)マウスを用いてその効果を検証しました。DS-4108bは、G6PC c.648G>T 発現ヒト細胞で認めるG6PC 異常スプライシングを是正し、G6Pase活性の回復に成功しました。また、DS-4108b皮下投与は、cKI-Mutマウスが示すG6PC異常スプライシングとG6Pase活性低下を是正するとともに、絶食時低血糖の改善、肝臓の代謝全体の改善、グリコーゲンや脂質蓄積の低下、肝腫大等の症状の改善を達成しました。さらに、マウス及びサルを用いた薬物動態及び安全性試験において、DS-4108bは良好なプロファイルを示しました。これらの結果から、月一回程度の投与頻度で空腹時低血糖の予防と、肝腫大等の従来治療介入困難だった症状の改善が期待されます。
本研究で作出したcKI-Mutマウスの病態をさらに精査し、投与開始時点の病態進行度によるSSOの有効性の違いや腎症状に対するSSOの効果について今後明らかにしていきたいと考えています。更なる非臨床試験・臨床試験を通じて、本研究の成果が糖原病Ia型の新たな治療薬につながることを期待しています。
・糖原病Ia型: 肝臓を中心にグリコーゲンが蓄積する肝型糖原病の1病型で、G6Pase-αの先天性機能欠損により発症する疾患です。本邦では、指定難病、小児慢性特定疾病に含まれており、有病率は約10万人に1人と推定されています。
・G6Pase-α:糖新生やグリコーゲン分解経路の最終酵素で、グルコース6リン酸からグルコースを産生する酵素です。主に肝臓・腎臓に発現し、血糖値が低くなると発現が上昇しグルコースを産生し血糖値を上昇させますが、血糖値が高い時には発現が抑制されます。G6Pase-αの機能が遺伝子変異によって損なわれる糖原病Ia型では、血糖値が低い時にもグルコースが肝臓・腎臓から産生されなくなるために、低血糖になりやすく、肝臓・腎臓にグリコーゲンが異常蓄積します。
・スプライシング: DNAからの転写産物(pre-mRNA)からタンパク質に翻訳されない領域(イントロン)を除去し、エクソンのみからなるmRNAに編集する機構です。スプライシングは核内で起こり、mRNAは核外へ運ばれタンパク質に翻訳されます。
・異常スプライシング: 遺伝子変異などが原因で正常なスプライシングができなくなり、異常なmRNAが産生される現象です。遺伝性疾患に関連する変異として報告されている一塩基変異のうち約35%が異常スプライシングによって疾患を引き起こしていると推定されています。
・代替スプライシング: 1つの遺伝子からスプライシング様式の異なる複数のmRNAを生成する機構です。発生段階や組織ごとに代替スプライシングが生じている遺伝子も少なくありません。真核生物のタンパク質の多様性の創出に大きく貢献する遺伝子発現制御機構と考えられています。
岡田 賢(おかだ さとし)
広島大学大学院医系科学研究科 小児科学 教授
TEL: 082-257-5212
E-mail: sokada*hiroshima-u.ac.jp
(注: *は半角@に置き換えてください)
掲載日 : 2023年12月04日
Copyright © 2003- 広島大学