大学院医系科学研究科 消化器内科学 講師 大野敦司
Tel:082-257-5191 FAX:082-257-5194
E-mail:atsushi-o*hiroshima-u.ac.jp
(*は半角@に置き換えてください)
本研究成果のポイント
- 血清中のIL-6※1が高い値となる場合、切除できない肝細胞癌の症例ではアテゾリズマブ+ベバシズマブ併用療法(Atezo+Bev)※2の治療効果を弱めることを発見しました。
- 血清IL-6が高い値となる場合の症例では、免疫複合療法が効きにくい腫瘍微小環境※3となり、Atezo+Bevの治療効果を弱める要因となっています。
- 本研究成果で、切除不能肝細胞癌における薬物療法の効果が事前に分かるようになりました。
概要
Atezo+Bevは現在切除不能肝細胞癌の治療の第一選択となっています。一方でAtezo+Bevでは治療効果が得られない症例も少なからず存在しています。どのような症例で治療効果が得られるかが予測できれば、治療戦略を計画する上で非常に役立ちます。
広島大学 大学院医系科学研究科 消化器内科学 三浦崚一大学院生、大野敦司講師、岡志郎教授らの研究グループは切除不能肝細胞癌症例のAtezo+Bev開始前の保存血清を用いた研究により、血清IL-6値がAtezo+Bevの治療効果の予測に有用である可能性を発見しました。
本研究ではAtezo+Bev治療開始前の血清中の17種のサイトカイン※4を測定し、Atezo+Bevの治療効果に関連するバイオマーカー※5の発見を試みました。その結果、血清IL-6が高値の場合、Atezo+Bevの治療効果が弱くなることが示されました。
更にAtezo+Bev開始前に肝生検検査により得られた肝腫瘍組織を用いて免疫組織化学染色(IHI)を行った所、血清IL-6が高値の症例では腫瘍内に、腫瘍免疫を抑制する作用を有する腫瘍随伴マクロファージ※6が腫瘍を攻撃する免疫細胞であるCD8陽性T細胞※7と比べ、相対的に多く存在していることがわかりました。加えてその傾向は治療効果が得られなかった症例で著明な傾向があることがわかりました。以上より血清IL-6高値の症例の腫瘍微小環境(TME)は免疫抑制性の環境となっており、その結果Atezo+Bevの治療効果が減弱している可能性が示されました。本研究を通じて血清IL-6測定が複数ある切除不能肝細胞癌患者の薬物療法の選択基準の一つとなることが期待されます。
本研究は日本学術振興会、武田科学振興財団の助成および日本医療科学研究開発機構のゲノム研究を創薬等出口に繋げる研究開発プログラムの一環として実施しました。
本研究成果は2024年12月9日に「Journal of Gastroenterology」オンライン版で公開されました。
なお、本研究は広島大学から論文掲載料の助成を受けています。
発表論文
- 論文名:Serum IL‑6 concentration is a useful biomarker to predict the efficacy of atezolizumab plus bevacizumab in patients with hepatocellular carcinoma
- 著者名:Ryoichi Miura1、Atsushi Ono1*、Hikaru Nakahara1、Yuki Shirane1、Kenji Yamaoka1、Yasutoshi Fujii2、Shinsuke Uchikawa1、Hatsue Fujino1、Eisuke Murakami1、Tomokazu Kawaoka1、Daiki Miki1、Masataka Tsuge1・3、Takeshi Kishi4、Waka Ohishi5、Naoya Sakamoto6、Koji Arihiro7、Clair Nelson Hayes1、Shiro Oka1
1. Department of Gastroenterology, Graduate School of Biomedical and Health Sciences, Hiroshima University Hospital, Hiroshima, 734-8551, Japan.
2. Department of Clinical Oncology, Graduate School of Biomedical and Health Sciences, Hiroshima University, Hiroshima, Japan.
3. Liver Center, Hiroshima University, Hiroshima, 734-8551, Japan.
4. Biosample Research Center, Radiation Effects Research Foundation, Hiroshima, Japan.
5. Department of Clinical Studies, Radiation Effects Research Foundation, Hiroshima, Japan.
6. Department of Pathology and Clinical Laboratories, National Cancer Center-Hospital East, Kashiwa, Chiba, Japan.
7. Department of Anatomical Pathology, Hiroshima University Hospital,
Hiroshima, Japan.
*責任著者 - 掲載雑誌名:Journal of Gastroenterology (Q1)
- DOI:10.1007/s00535-024-02185-w
背景
肝臓癌は癌による死亡原因としては肺癌、大腸癌についで第3位の原因となっており、局所療法が選択不能となった場合には適切な薬物療法を選択することが重要となります。切除不能肝細胞癌に対する免疫チェックポイント阻害薬※8の適応により、薬物療法の選択肢は大きな広がりを見せており、多くの患者様で薬物療法の恩恵を受けることができるようになりました。Atezo+Bevは肝細胞癌に対して使用可能な免疫チェックポイント阻害薬を用いた薬物療法の一つで、現在第一選択薬となっています。Atezo+Bevは高い治療効果を有している一方で、治療効果の得られない症例も存在しており、治療効果を予測するバイオマーカーの探索は大きな課題の一つです。
研究成果の内容
本研究ではAtezo+Bevもしくは従来の薬物療法の第一選択であったレンバチニブ(免疫療法ではない治療)を投与された症例を対象として、治療開始前保存血清を使用し17種のサイトカインを測定し、Atezo+Bev特有のバイオマーカーの探索を試みました。その結果血清IL-6がAtezo+Bev特有のバイオマーカーであり、血清IL-6高値の症例では、低値の症例と比較して無増悪生存期間※9、全生存期間※10ともに有意に短縮することがわかりました。更にAtezo+Bevとレンバチニブ投与症例を比較した所、全症例の比較では2種類の治療薬の治療効果に有意な差はありませんでしたが、血清IL-6低値の症例のみで比較した所、Atezo+Bev症例の方がレンバチニブ症例より無増悪生存期間が有意に延長することがわかりました。血清IL-6の高低差で腫瘍のTMEはどのように変化しているか評価するためにAtezo+Bev治療開始前の肝生検検体を用いてIHCを施行し、TMEの評価を行った所、IL-6高値の症例では腫瘍随伴マクロファージがCD8陽性T細胞より相対的に多く、治療効果別でみると治療効果が得られなかった症例でその傾向が著明であることを発見しました。
今後の展開
今回の研究結果は血清IL-6高値の症例では腫瘍の腫瘍微小環境は腫瘍を攻撃してくれる免疫細胞が少ない(免疫抑制的な)環境となっており、その結果Atezo+Bevの治療効果が減弱している可能性を示しております。現在切除不能肝細胞癌の一次治療の選択肢は複数存在しておりますが、その治療選択基準となり得るバイオマーカーは発見されておりません。本研究を契機に、症例データが蓄積され、血清IL-6測定が複数ある切除不能肝細胞癌患者の薬物療法の選択基準の一つとなることが期待されます。
用語解説
※1 IL-6:インターロイキン-6のことでサイトカインと呼ばれるたんぱく質の一種で、免疫応答や炎症反応の調節に関与しています。
※2 アテゾリズマブ+ベバシズマブ併用療法(Atezo+Bev):免疫チェックポイント阻害薬※8のアテゾリズマブ(Atezo)と血管新生阻害剤のベバシズマブ(Bev)の併用療法(Atezo+Bev)は現在切除不能肝細胞癌の治療の第一選択となっています。
※3 腫瘍微小環境:腫瘍組織やその周囲の混在する免疫細胞や血管・繊維などにより構成される環境のこと。腫瘍の進行に大きな役割を果たしており、免疫チェックポイント阻害薬の治療効果にも大きく関わっていると考えられています。
※4 バイオマーカー:疾患の有無や病状評価、治療効果の指標となり得る測定可能な検査項目のこと。
※5 サイトカイン:細胞から分泌されるたんぱく質のことで、細胞間の情報伝達を担っており、様々な生理活性を引き起こします。
※6 腫瘍随伴マクロファージ:腫瘍の周囲に存在する免疫細胞の一つで、癌細胞の増殖や浸潤を手助けし、細胞障害性T細胞を抑制することで癌の進行を手助けしていると考えられています。
※7 CD8陽性T細胞:リンパ球の一つであるT細胞の内、ウイルス感染細胞やがん細胞を認識し傷害する役割を担った細胞のことで、癌免疫において抗腫瘍効果に大きく関わっています。
※8 免疫チェックポイント阻害薬:癌細胞がリンパ球などの免疫細胞の攻撃を逃れる仕組みを解除することで免疫細胞の力を回復させ癌治療を行う薬剤のこと。癌そのものを攻撃する従来の薬物療法とは異なるアプローチで治療を行うことで、高い治療効果が報告されています。
※9 無増悪生存期間:癌の治療効果を評価する指標の一つで、癌の病勢が進行せずに安定した状態が続く期間のこと。
※10 全生存期間:癌の治療効果を評価する指標の一つで、治療開始後、患者様が亡くなるまでの期間のこと。
参考資料
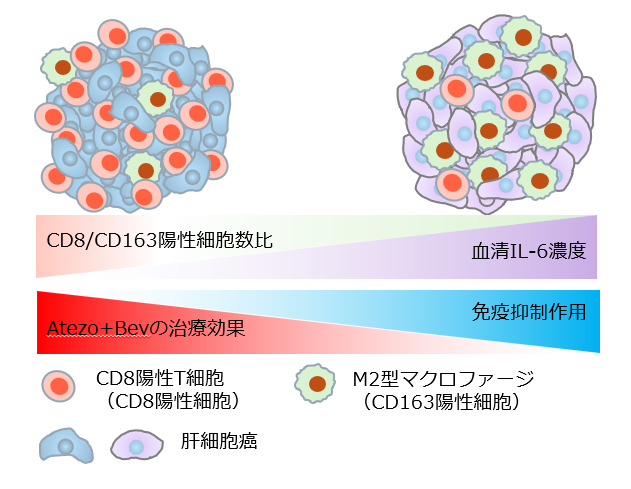
図1 研究成果をまとめた模式図
血清IL-6濃度が高い症例ほど腫瘍内の腫瘍随伴マクロファージの一つであるM2型マクロファージ(CD163陽性細胞)の浸潤がCD8陽性T細胞(CD8陽性細胞)の浸潤と比べ、相対的に強くなることで、腫瘍に対する免疫力は抑制され、Atezo+Bevの治療効果は低下すると考えられます。
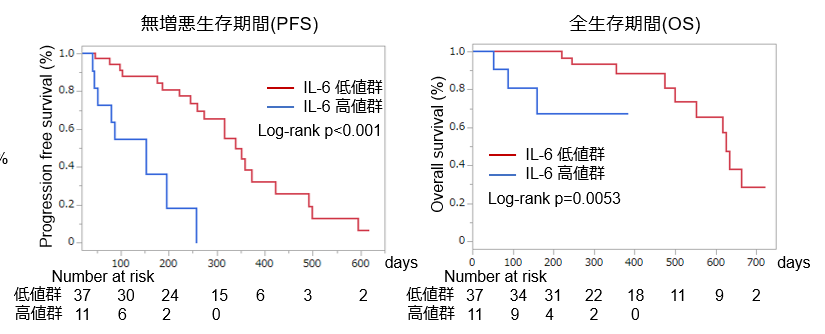
図2 Atezo+Bev治療における血清IL-6の高低別の無増悪生存期間と全生存期間の比較
無増悪生存期間(左図)、全生存期間(右図)いずれも血清IL-6高値の症例では低値の症例より生存期間が有意に低下しています。
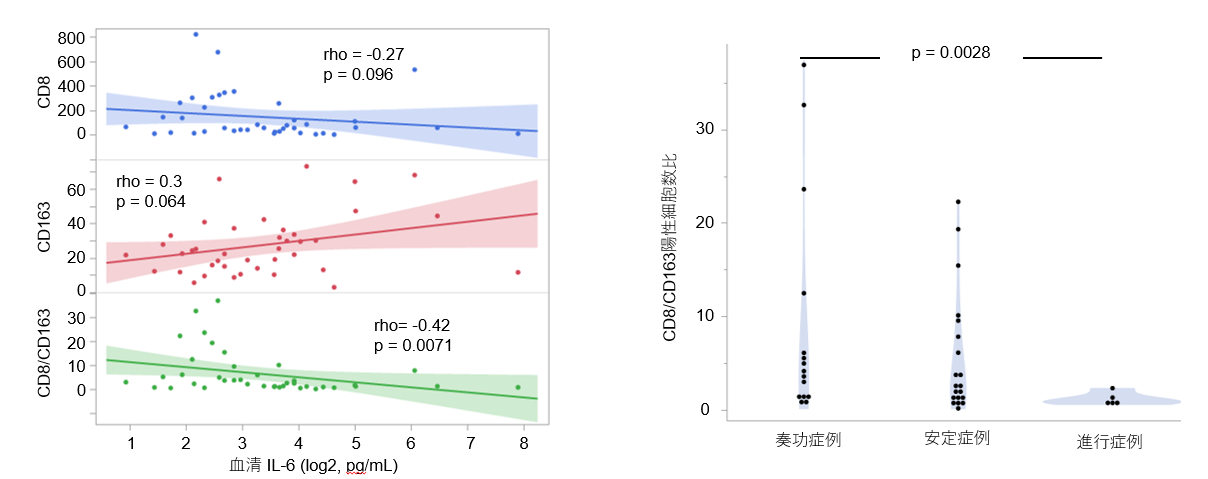
図3 血清IL-6と治療効果別に見た肝腫瘍組織内浸潤CD8・CD163陽性細胞数の比較
血清IL-6高値となると抗腫瘍効果を有するCD8陽性T細胞浸潤は低下し、腫瘍促進作用を有するM2型マクロファージ(CD163陽性細胞)浸潤は亢進します。CD8/CD163陽性細胞数比で評価するとその傾向はより明らかとなります。更に治療効果別で評価すると、治療効果を有していた症例(CR/PR)と治療効果が得られなかった症例(PD)を比較すると、治療効果が得られなかった症例でCD8/CD163陽性細胞数比は有意に低下します。

 Home
Home

