広島大学大学院医系科学研究科 消化器・移植外科学
教授 大段秀樹
Tel:082-257-5220 FAX:082-257-5224
E-mail:hohdan@hiroshima-u.ac.jp
本研究成果のポイント
- 肝臓移植の際に拒絶反応が起こるかどうかは、免疫の働きを決める「SIRPα遺伝子」の違いが関係していることを世界ではじめて明らかにしました。
- この成果により、患者ごとに拒絶反応が起きるリスクを予測し、治療法の個別化・最適化を目指します。
概要
広島大学の研究チーム(広島大学 大学院医系科学研究科 消化器・移植外科学 大段秀樹 教授、Akhmet Seidakhmetov医師、呉医療センター 谷峰直樹医師、ら)は、日本人154組の生体肝移植ドナー(提供する人)・レシピエント(受ける人)ペアを対象に肝移植の拒絶反応に関する研究を行いました。
その結果、肝臓移植の際に拒絶反応がおこるかどうかは、免疫の働きを決める「SIRPα遺伝子」の違いが関係していることを明らかにしました。具体的には、「SIRPα遺伝子」の「V2型」をもつ人では、急性拒絶反応の発生率が高いことを発見しました。
この研究成果は、国際学術誌 『PNAS Nexus(Q1)』(米国科学アカデミー機関誌系列) に掲載されました。
また、本研究成果は広島大学から論文掲載料の助成を受けています。
論文タイトル
Impact of SIRPα Genotype Combinations in Recipients and Donors on Alloimmune Response in Liver Transplantation
著者
Akhmet Seidakhmetov, Naoki Tanimine, Yuka Tanaka, Ryosuke Arata, Ryosuke Nakano, Hiroshi Sakai, Masahiro Ohira, Hiroyuki Tahara, Kentaro Ide, Tsuyoshi Kobayashi, Hideki Ohdan*
*:責任著者
DOI:[10.1093/pnasnexus/pgaf351]
背景
肝硬変や肝臓がんなどにより、肝臓の機能が回復できないほど悪くなった患者では、肝臓移植が効果的な治療法となります。しかし臓器移植をする際には、患者自身の免疫が、移植された臓器を異物であると判断し攻撃してしまう「拒絶反応」が最大の課題です。
これまでの研究成果において、拒絶反応は主に「HLA遺伝子(免疫システムが「自己」と「非自己」を見分けるための目印のようなもの)」の不一致によって説明されてきました。移植された臓器と移植を受ける身体のHLA遺伝子が違うため、免疫システムが勘違いし、拒絶反応を起こしてしまうという仕組みです。しかし、HLA遺伝子が一致していても拒絶が起こる症例が存在しており、仕組みの解明が求められていました。
研究成果の内容
「CD47」とは、ほとんどすべての細胞の表面にある「この細胞は自己の細胞である」という目印のようなものです。一方「SIRPα」とは、免疫細胞がCD47を感知するためのたんぱく質で、「SIRPα」と「CD47」が結合すると、免疫の誤作動が防がれます。これは「自己細胞を食べない」ための分子シグナルであり、「“don’t eat me”シグナル」とも呼ばれています。本研究グループはこれまで、動物種の異なる生物間で臓器を移植する「異種移植」の研究で、この「SIRPα–CD47経路」がとても重要であることを報告してきました。
今回の成果は、この仕組みが ヒトとヒトのあいだで行われる通常の臓器移植(同種移植)でも働いていることを、臨床データを用いて初めて明らかにしたものです。
解析の結果、SIRPα遺伝子には複数の多型が存在し、日本人では「V1」と「V2」型が主要であることが判明しました。V2型SIRPαはCD47との結合力が強く、T細胞活性化を促進する性質を持つことを、ヒト血液細胞を用いた実験で確認しました。
さらに、85組の肝移植ドナー・レシピエントの遺伝子組み合わせを解析し、V2型を多く含む組み合わせでは、急性拒絶反応の発生率が約1.5倍高いことを明らかにしました。
これらの知見をもとに、研究チームはSIRPα遺伝子型に基づいた「免疫反応強度スコア」を提案。このスコアにより、移植前に拒絶リスクを予測し、免疫抑制薬の投与計画を個別化できる可能性が示されました。
今後の展開
本研究は、移植免疫学における「新たな遺伝子マッチング指標」としてSIRPαを提案するものです。
今後は、腎移植など他臓器でも同様の検証を進め、SIRPα遺伝子検査を用いた拒絶反応リスク予測モデルの臨床応用を目指します。
さらに、免疫チェックポイント分子CD47との関連から、がん免疫療法や自己免疫疾患の治療戦略にも応用が期待されます。
参考資料
- SIRPα(Signal Regulatory Protein Alpha):免疫細胞が「自己」を認識するための受容体。CD47と結合し、攻撃を抑制する信号を送る。
- CD47:「自分を食べないで」というシグナルを発する細胞膜分子。がん細胞でも高発現が知られる。
- 本研究では、SIRPα遺伝子のV2型がCD47との結合を強め、免疫細胞の活性化を促すことを発見。
- HLA遺伝子とは、「ヒト白血球抗原(Human Leukocyte Antigen)」をつくる遺伝子。免疫システムが“自分”と“他人”を見分けるための最も重要な遺伝子群であり、「免疫の指紋」とも呼ばれる。
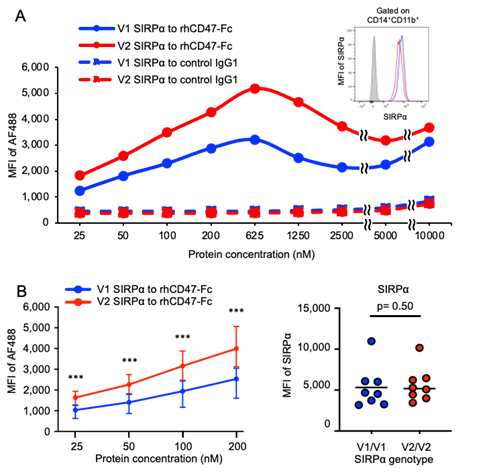
(図1)この図は、人の免疫細胞に発現しているSIRPαというたんぱく質が、CD47というたんぱく質とどの程度強く結合するかを調べた実験結果を示しています。
研究では、健康なボランティアから採取した血液中の免疫細胞を使い、SIRPα遺伝子の型が「V1型」か「V2型」かによって結合の強さが違うかを比較しました。
CD47たんぱく質を蛍光で光るようにして細胞に加え、その光の強さ(平均蛍光強度:MFI)を測ることで、どのくらいCD47がSIRPαに結合したかを定量的に評価しました。
結果として、V2型をもつ人の免疫細胞は、V1型をもつ人よりもCD47と強く結合することが明らかになりました(図中の赤い点がV2型、青い点がV1型)。
このことから、SIRPαの遺伝的な違いが免疫の強さや拒絶反応に影響する可能性があることが示唆されます。
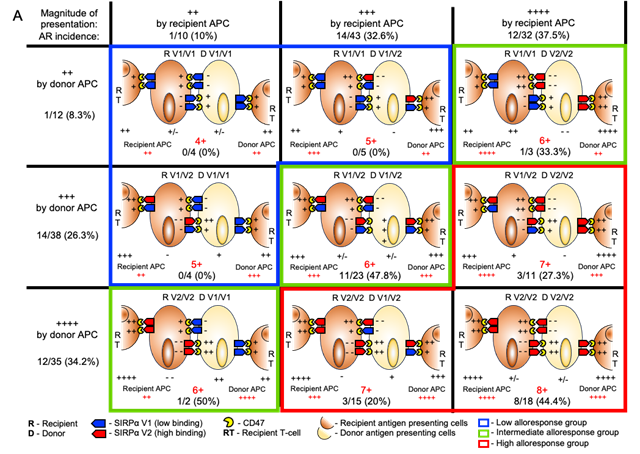
(図2)この図は、ドナーとレシピエントそれぞれが持つ SIRPα 遺伝子型が組み合わさった時にどれくらい免疫が強く反応しやすいかモデル化し、拒絶発症率との関連を解析した結果を示しています。ドナーとレシピエントの免疫細胞(抗原提示細胞:APC)とT細胞の活性化の強さを、「+」の数で表しています。「+」が多いほど免疫反応が強く、拒絶反応が起こりやすい可能性があります。この免疫反応の強さを合計して、以下の3つのグループに分類しました:
• 4+〜5+:拒絶反応が起こりにくい(低リスク)
• 6+:中程度のリスク
• 7+〜8+:拒絶反応が起こりやすい(高リスク)
つまり、このモデルは「ドナーとレシピエントのSIRPα遺伝子の組み合わせによって、移植後の拒絶反応の起こりやすさを予測できる」ことを示したものです。()内の数値は拒絶反応の発症率です。

 Home
Home

