【研究室主要論文】
・Uchida Y, Sasaki H, Terasaki T. Establishment and validation of highly accurate formalin-fixed paraffin-embedded quantitative proteomics by heat-compatible pressure cycling technology using phase-transfer surfactant and SWATH-MS, Sci Rep, 2020;10:11271.
・Handa T, Sasaki H, Takao M, Tano M, Uchida Y. Proteomics-based investigation of cerebrovascular molecular mechanisms in cerebral amyloid angiopathy by the FFPE-LMD-PCT-SWATH method. Fluids Barriers CNS. 2022;19(1):56.
・Uchida Y, Goto R, Usui T, Tachikawa M, Terasaki T. Blood-arachnoid barrier as a dynamic physiological and pharmacological interface between cerebrospinal fluid and blood.“Drug Delivery to the Brain - Physiological Concepts, Methodologies and Approaches”, ed., by R. Thorne, L. de Lange, M. Hammarlund-Udenaes, Springer, pp 93-121, 2022.
・Hashimoto Y, Zhou W, Hamauchi K, Shirakura K, Doi T, Yagi K, Sawasaki T, Okada Y, Kondoh M, Takeda H. Engineered membrane protein antigens successfully induce antibodies against extracellular regions of claudin-5. Sci Rep. 2018;8(1):8383.
・Akai M, Maeda Y, Kawami M, Yumoto R, Takano M, Uchida Y. miR-PAIR: microRNAs-Proteins Analysis of Integrative Relationship for the identification of significant miRNAs. Biochim Biophys Acta Gen Subj, 2025;1869(2):130746.
【教育内容】
講義・実習では、薬物動態学や薬剤学の基礎を全般的に教育します。研究室に配属後は、これらの学問をベースに、生化学、分子生物学、薬理学、分析化学、バイオインフォマティクス、プロテオミクスなど様々な学問や技術を取り入れて、学生が分野横断的に幅広い視野を身につけられるよう教育しています。
研究は、学部時代の講義の成績と関係なく、誰しもが成功できる・得意になれる可能性がある活動です。この鍵は、楽しめるかどうかです。どんな芸術やスポーツでも、選手として楽しめるようになるためには、それなりの努力と時間が必要です。研究には、世界の誰も見たことのないことについて世界で初めて自分が発見できる楽しみや、自身のアイデアを実験的に証明することができる楽しみがあります。この楽しさを味わえるようになれるよう、全力でサポートいたします。
また、博士号取得へのチャレンジを推奨しています。20代は、人生で最も自分を試せる・成長させられる時期です。何事も、5年以上、一つのことに没頭している人の話は面白いと言われます。様々な経験と試行錯誤の末に養われる問題解決能力は、どの分野にでも、多様な職種にも応用可能であるため、博士号取得はかけがえのない人生の自信になります。
【研究内容】
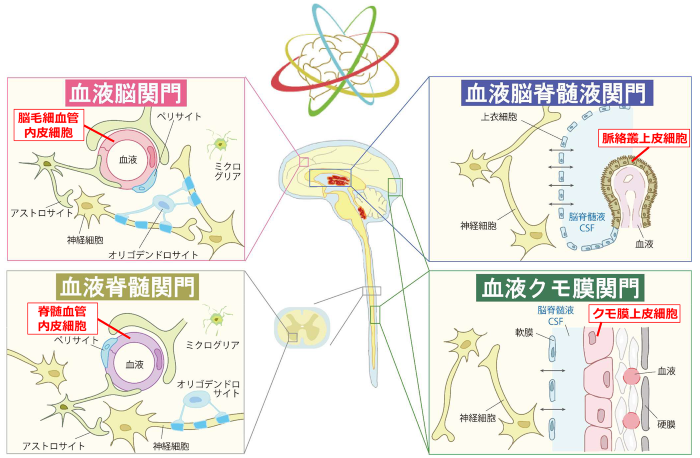
中枢組織には、血液脳関門(BBB)に加えて、血液脳脊髄液関門(BCSFB)、血液クモ膜関門(BAB)および血液脊髄関門(BSCB)の4種類の関門組織が存在し、末梢(血液)と中枢組織内を隔てています。これらをまとめて中枢関門と呼びます。
中枢疾患治療薬の新薬開発における課題
①薬の標的となる分子は中枢関門を超えた中枢組織内に存在するという概念が一般的であるため、②薬は中枢関門を通過して中枢組織内へ到達する必要がありますが、99%以上の薬はP糖タンパク(P-gp)などの排出ポンプによって中枢への侵入が妨げられています。③タンパク質・遺伝子やナノ粒子などの高分子に至っては中枢関門を全く通過できません。このように、既存の技術や考え方を今後継続しても、中枢疾患治療薬を効率よく開発できる未来は期待できません。
これに対して、我々は、中枢関門の細胞自体を治療薬・診断薬の標的と捉え、創薬を行うことで、脳移行性の課題を解決し(中枢関門の通過を必要としない創薬)、中枢疾患の新たな創薬フィールドを開拓します。中枢関門は、脳内環境に影響を与えているため、中枢内の病気の重要な原因のひとつとして、関門の異常があげられます(中枢組織内の病態の結果として関門が異常になる場合もあります)。その関門の異常を治療・診断することによって中枢疾患を治療・診断できる、というこれまでにない新しい創薬戦略を確立したいと考えています。以下の4つの構想を具現化していき、新学問「中枢関門創薬学」を創成することを目標に、日々、研究に取り組んでいます。
構想1
中枢疾患における中枢関門の病態分子機構を解明し、中枢疾患の発症・進行への寄与を証明します。我々の強みは、マウスに限らず、ヒトの中枢関門の病態分子機構を定量プロテオミクスで解明する技術を保有していることです。特に、ヒトの組織検体は、ホルマリン固定されているため、網羅的な分子機構を定量的に解析することは困難とされてきましたが、我々は、ホルマリン固定パラフィン包埋切片(FFPE)に対する高精度な定量プロテオミクス技術を独自に開発し、脳内の各中枢関門をレーザーマイクロダイセクションで採取して定量プロテオミクス解析を実施しています。定量プロテオミクス解析で候補にあがる責任分子あるいは責任分子機構を、アデノ随伴ウィルス(AAV)を用いたin vivo遺伝子工学技術で中枢関門細胞選択的に発現制御することによって、中枢疾患病態の発症・進行への寄与を証明します。
構想2
他臓器に比べ、中枢関門に、より高発現する膜タンパク質を同定し、抗体を作製し、取り込み速度を評価することによって、それぞれの中枢関門細胞内へ効率よく抗体を送達する技術を確立します。我々の強みは、膜タンパク質の絶対発現量(mole)を網羅的かつ高精度に定量する技術(quantitative Global Absolute Proteomics (qGAP法))を開発している点です。この技術を用いて、中枢関門細胞の血液側細胞膜に局在する膜タンパク質の絶対発現量を網羅的に解明し、他臓器に比べて各中枢関門に選択的に高発現する膜タンパク質を選抜します。候補の膜タンパク質の細胞外領域に対する抗体を作製し、複数の抗体候補の中から、最も高速に中枢関門細胞内へ取り込まれる抗体を同定します。
構想3
中枢関門を標的とする中枢疾患治療の有効性を実証します。我々の強みは、病態分子機構(病態における様々なタンパク質発現量の変化)を正常化できる低分子薬および核酸の配列(miRNA, ASO, siRNA)を予測できる独自のアルゴリズムを開発している点です。例えば、従来の治療用miRNA配列の予測法は、病態時におけるトランスクリプトームデータに基づいて、病態を正常化できると予想されるmiRNA配列を選ぶものでありましたが、タンパク質発現レベルの病態分子機構を十分に正常化することができませんでした。これに対して、我々が開発したアルゴリズム「miR-PAIR法」は、病態に直結するタンパク質群の分子機構を正常化できるmiRNA配列を予測できるものです。これらの技術を用いて、構想1で解明される中枢関門の病態分子機構を正常化できる低分子薬、miRNA、ASO/siRNAを選抜し(核酸は構想2の抗体との複合体を作って)、疾患モデル動物に投与することによって中枢疾患病態を治療できることを実証します。
構想4
中枢関門の状態を計測することによって、脳内環境(中枢疾患)を診断する仕組みを作ります。構想2で開発する抗体にイメージングプローブを修飾し、投与することで、中枢関門内に診断プローブを導入でき、中枢関門の環境を測定することができます。脳内と中枢関門は互いに影響し合う関係であるため、脳内の異常は、中枢関門に現れます。診断プローブによって画像診断する方法に加えて、中枢関門から血液中に漏出する疾患バイオマーカーを血液診断することによって、中枢疾患の新たな診断基盤「中枢関門診断」を確立します。

 Home
Home