広島大学 生物生産学部 藤井創太郎
E-mail:sofuji*hiroshima-u.ac.jp (注: *は半角@に置き換えてください)
広島大学 生物生産学部 三本木至宏
E-mail:sambongi*hiroshima-u.ac.jp (注: *は半角@に置き換えてください)
一酸化窒素(NO)は、血管弛緩等のシグナル伝達分子として、また高濃度では細胞毒性種として機能するガス状分子です。鉄を含んだヘム蛋白質は、NOの感知や解毒に関わる重要かつ多様な役割を担っています。蛋白質のヘム周辺の構造が、NOの反応性を制御していることで知られています。
微生物から見出されるヘム蛋白質「シトクロムc'」はNOに特異性があります。好熱菌から好冷菌まで、様々なグラム陰性菌からシトクロムc'は見出されます。そのヘム周辺構造は、由来する微生物によって少しずつ異なっていますが、どのようにヘム構造がNOの結合を制御しているかは未知でした。
広島大学生物生産学部の藤井創太郎助教および三本木至宏教授は、英国欧州放射光施設(Diamond Light Source)、英国Essex大学、および米国Oregon大学の研究グループと共同で、構造生物学的および分光学的手法を用いて、好熱菌Hydrogenophilus thermoluteolus(旧名:Pseudomonas hydrogenothermophila)がもつシトクロムc'(PhCP)のNO結合メカニズムの解明を試みました。
NO結合の分光的な速度論解析の結果、PhCPのNO結合には中間体が形成されることが示され、常温菌や好冷菌の相同シトクロムc'と比べて、PhCPの中間体および最終生産物のためのNO結合がゆっくり進むことを明らかにしました。そしてX線結晶構造解析により、PhCPのNO結合時の蛋白質立体構造を決定することに成功しました。構造解析の結果、PhCPでは、本来起こるべきNO結合のアミノ酸残基のコンフォメーション変化(132番目のアルギニン残基が外側へ動くこと)が、ヘム周辺の塩橋形成により妨げられていることが示唆されました(図1)。また、PhCPヘム周辺に形成された水素結合が、中間体構造の速度を遅くする要因である可能性も示唆されました。すなわち、これらの相互作用の増加による強固な立体構造の形成が、「ゆっくりしたNO結合」の要因となる可能性を示しました。
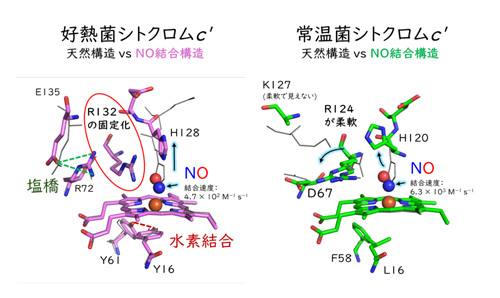
図1
NO結合に伴う好熱菌シトクロムc'蛋白質のコンフォメーション変化、
および常温菌由来相同蛋白質との比較
本研究成果は、金属蛋白質がNOを感知するための錯体化学に関する基礎的知見を提供し、さらにシトクロムc'を応用したNO感知バイオミメティクス(生体模倣素材)の開発に向けた基盤的知見となります。
本研究は日本学術振興会海外特別研究員制度および科研費(23H02183)、アメリカ国立科学財団(MCB-1921670)の支援を受けて実施されました。また本研究は、英国欧州放射光施設(Diamond Light Source LtD)、英国Essex大学および米国Oregon大学との共同研究で実施されました。
広島大学 生物生産学部 藤井創太郎
E-mail:sofuji*hiroshima-u.ac.jp (注: *は半角@に置き換えてください)
広島大学 生物生産学部 三本木至宏
E-mail:sambongi*hiroshima-u.ac.jp (注: *は半角@に置き換えてください)
掲載日 : 2024年07月09日
Copyright © 2003- 広島大学