広島大学 生物生産学部 藤井創太郎
E-mail:sofuji*hiroshima-u.ac.jp (注: *は半角@に置き換えてください)
広島大学 生物生産学部 三本木至宏
E-mail:sambongi*hiroshima-u.ac.jp (注: *は半角@に置き換えてください)
深海環境は、低温かつ高圧の極限環境であることが知られています。その環境に適応した微生物由来のタンパク質を研究することは、タンパク質の安定性を向上させるなど新しい技術の発展に貢献します。
琉球海溝の深度約5,000–7,000mに生息する微生物Shewanella benthicaおよび Shewanella violaceaは、相同タンパク質、シトクロムc'(それぞれ、SBCPおよびSVCP)を有します。SBCPおよびSVCPの熱変性中点温度(Tm)はそれぞれ55 ℃、47 ℃であり8 ℃異なりますが、その安定性の差は、129アミノ酸のうち、9つの異なるアミノ酸置換に起因するはずです。そこで本論文では、SBCPへより安定性の低いSVCPで対応するアミノ酸残基を導入した変異実験により、両者の安定性の差の要因を調べました。
SBCPの9つの変異体すべてのギブス自由エネルギー変化を解析したところ、87番目のリジンをバリンに置換したK87V変異体の熱安定性が最も低下することを見出しました(図1)。この変異によって、野生型でリジンが91番目のアスパラギン酸と形成していた塩橋が消失します。次に、K87V変異体のX線結晶構造解析を行ったところ、変異導入したバリンの周囲の水分子がかご状のクラスレート構造を形成することを見出しました(図1)。したがって、塩橋の消失に加えてK87V変異体が野生型に比べて周囲の水分子をより制限するためエントロピーの不利益が大きくなることも、安定性が低下する要因であると考察しました。
本論文の知見は、分子表面の塩橋の有無によりタンパク質安定性を制御し得ることを示すものです。このような知見の蓄積により、タンパク質安定性の原理解明や応用技術発展につながると考えています。
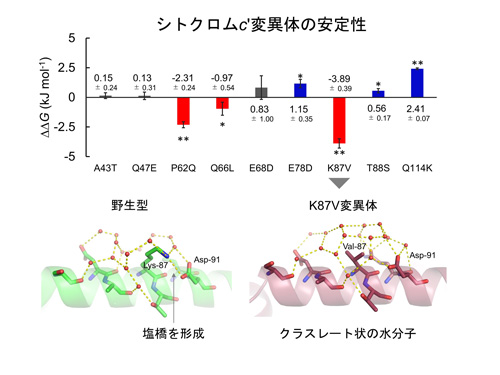
図1
SBCPシトクロムc'への変異導入による安定性変化と
K87V変異体のX線結晶構造(赤点は水の酸素原子を示す)
広島大学 生物生産学部 藤井創太郎
E-mail:sofuji*hiroshima-u.ac.jp (注: *は半角@に置き換えてください)
広島大学 生物生産学部 三本木至宏
E-mail:sambongi*hiroshima-u.ac.jp (注: *は半角@に置き換えてください)
掲載日 : 2023年10月20日
Copyright © 2003- 広島大学