本研究成果のポイント
- 頭頸部癌や肺癌における上皮成長因子受容体(EGFR)の遺伝子異常が、チロシンリン酸化を介してシグナル経路の一つであるHippo経路を制御し、下流の癌遺伝子YAP/TAZを活性化させ、癌細胞の増殖亢進およびEGFR 阻害薬に対する耐性を付与する新たな分子機構を解明しました。
- YAP/TAZを標的とする薬剤を併用することで、EGFR阻害薬への耐性獲得を防ぐ新たな治療法の開発が今後期待されます。
概要
広島大学病院口腔検査センターの安藤俊範助教(※)およびカリフォルニア大学サンディエゴ校のJ. Silvio Gutkind 教授らの研究グループは、頭頸部癌や肺癌で生じるEGFRの遺伝子異常が、チロシンリン酸化を介してHippo経路を制御することで下流の癌遺伝子YAP/TAZ を活性化し、癌細胞の増殖および EGFR阻害薬への耐性を付与することを解明しました。
本研究により、EGFR阻害薬への耐性獲得を防ぐために、YAP/TAZを分子標的とする薬剤の併用が有効である可能性が示唆されます。
本研究の成果は、英国時間の11月1日午前10時(日本時間2021年11月1日午後7時)に「Communications Biology」オンライン版に掲載されます。
(※) 元カリフォルニア大学サンディエゴ校(UCSD)のポスドク研究員および広島大学大学院医系科学研究科特任助教(UCSDと広島大学間のクロスアポイントメント制度で採用)
発表内容
【背景】
細胞内には様々なシグナル経路が存在し、細胞の増殖・生存を制御しています。Hippo経路(注1)およびその下流の癌遺伝子であるYAP/TAZ(注2)は、細胞増殖、臓器形成に非常に重要なシグナル経路として近年注目されています。特に癌では様々な遺伝子異常がHippo経路を制御することでYAP/TAZを異常に活性化し、増殖を促進しています。頭頸部癌や肺癌でもYAP/TAZの異常な活性化が癌の発生・進展に寄与していることは知られており、いくつかの遺伝子異常が原因であることは分かっていましたが、他の遺伝子異常が関与している可能性が示唆されており、更なる解明が望まれていました。
EGFR(注3)は細胞の増殖において非常に重要な受容体型チロシンキナーゼであり、EGFなどのリガンド(注4)が結合することで活性化し、増殖に関わる複数のシグナル経路を活性化させることが知られていましたが、Hippoシグナル経路との関連については解明されていませんでした。EGFRは様々な腫瘍で遺伝子異常が生じており、例えば頭頸部癌の主な亜型である頭頸部扁平上皮癌では EGFR の遺伝子増幅や過剰発現が生じることから、cetuximab という分子標的薬が治療として既に使われていますが、単剤による効果は高くありません。一方、肺癌の亜型である肺腺癌ではEGFR の遺伝子変異(日本人では肺腺癌の約50%)が生じ、チロシンキナーゼ阻害薬という分子標的薬が治療として使用されています。治療効果は比較的高いですが耐性獲得が問題となっています。頭頸部扁平上皮癌、肺腺癌のいずれの場合も、EGFR阻害薬に対する耐性機序の解明が望まれています。
研究グループは、高頻度に遺伝子異常を示すEGFRがHippo経路を制御しYAP/TAZの活性化を導く可能性を見出したため、EGFRによるHippo経路制御機構を詳細に解明することを目的に研究を行いました。
【研究成果の内容】
研究グループは、まず腫瘍細胞株の遺伝子発現データベースを用いた解析から、EGFR高発現細胞がYAP/TAZ活性化を示すことを見出しました。次にEGFRがYAP/TAZの脱リン酸化を促し、核内に移行させ、増殖関連遺伝子の転写を促進することを明らかにしました(図1)。EGFRはHippo経路構成要素の一つであるMOB1の3箇所のチロシン残基のリン酸化を促進することで、LATS1/2(注1)の不活性化を引き起こし、YAP/TAZを活性化させることを明らかにしました(図2)。トランスクリプトーム解析(注5)により、EGFR阻害薬はYAP/TAZによる増殖関連遺伝子群の発現を抑制することを見出しました。LATS1/2の発現をノックアウト(消失させる)することでYAP/TAZが活性化した細胞は、EGFR阻害薬に対して耐性を示すことが明らかになりました(図3)。
【今後の展開】
本研究により、EGFRがMOB1チロシンリン酸化を介してHippo経路を制御し、YAP/TAZ活性化を導く詳細な機構が明らかになりました。一方で、EGFR阻害薬は頭頸部扁平上皮癌や肺腺癌で既に使用されていますが、薬剤耐性が問題になっており、その機構の解明と治療が望まれています。EGFR阻害薬に対して耐性を示す症例では、未知の機構によりYAP/TAZが活性化していることが報告されています。本研究からEGFR阻害薬がMOB1チロシンリン酸化を介してYAP/TAZを確かに抑制するが、未知の機構によるYAP/TAZ活性化が耐性を付与すると推察されます。今後、YAP/TAZそのものを標的とする創薬の開発への展開が期待されます。また、YAP/TAZ活性化を誘導する未知の機構を今後解明していくことで、EGFR阻害薬耐性を防ぐ新たな治療法の確立へと展開していく予定である(図4)。
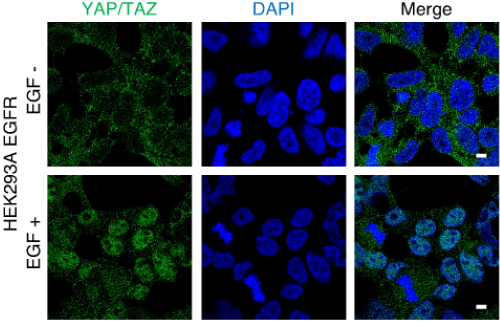
図1 EGFR活性化はYAP/TAZを核内に移行させる
EGFRを過剰発現するHEK293A細胞にEGFを投与すると、EGFRが活性化し、YAP/TAZ(緑色)が細胞質内(上段)から核内(下段)へと移行する像を認める。(DAPI:核を染色、Merge:緑色と青色の重ね合わせを免疫蛍光染色で解析)
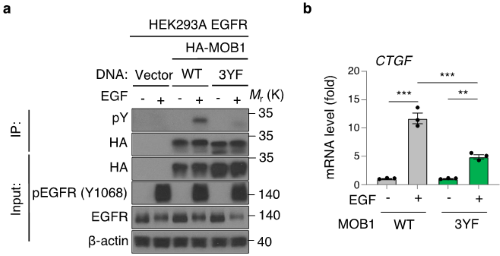
図2 MOB1のチロシン残基リン酸化はYAP/TAZの活性化に重要である
(a) EGFRを過剰発現するHEK293A細胞に、コントロールとしてVector単独、野生型MOB1(WT)、3箇所のチロシン残基を非リン酸化型のフェニルアラニンに置換したMOB1(3YF)を過剰発現させ、EGF投与前後のチロシンリン酸化を比較した。「pY」のレーンのチロシン残基リン酸化がEGF投与時にWTでは見えるが、3YFで消失している。
(b) MOB1 WTと3YFを過剰発現させ、EGFで刺激すると、WTはYAP/TAZの転写標的遺伝子CTGFの発現量を亢進したが、3YFではその抑制が見られた。
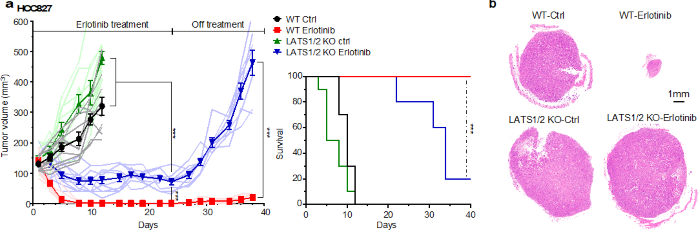
図3 YAP/TAZ活性化はEGFR阻害薬に対する耐性を付与する
(a) WT(野生型)とLATS1/2 KO(LATS1/2遺伝子ノックアウトによるYAP/TAZ活性化)の細胞をヌードマウスに移植し、EGFR阻害薬(Erlotinib)を投与すると、WTとLATS1/2 KO群のいずれも増殖の抑制が見られたが、LATS1/2 KO群はWT群ほどでは増殖抑制が見られず、Erlotinib投与をやめるとLATS1/2 KO群は再増殖した。LATS1/2 KO群はWT群に比べて生存率が低下する。
(b) YAP/TAZ活性化群の摘出時の腫瘍サイズはWT群に比べて大きい。
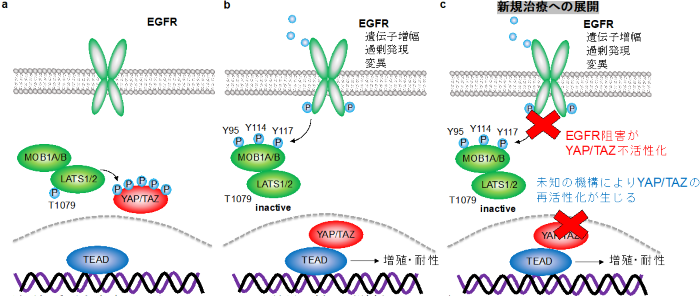
図4 YAP/TAZ活性化はEGFR阻害薬に対する耐性を付与する
(a) EGFRが不活性化している時は、LATS1/2がYAP/TAZをリン酸化することで細胞質内に局在させることで、YAP/TAZは不活性化状態にある。
(b) EGFRの遺伝子増幅、過剰発現、変異を示す癌細胞では、活性化したEGFRがMOB1の3箇所のチロシン残基のリン酸化(95, 114, 117番目)を引き起こすことでLATS1/2の不活性化を引き起こし、脱リン酸化されたYAP/TAZは核内に移行して増殖・薬剤耐性を付与する。
(c) EGFR阻害はYAP/TAZ不活性化を一時的に引き起こすが、EGFR阻害薬耐性を示す症例では未知の機構によりYAP/TAZの再活性化が生じる。YAP/TAZ標的治療薬を併用することでEGFR阻害薬への耐性獲得を防ぐことが可能になる。また未知の機構の解明が、YAP/TAZ再活性化を防ぎ耐性を予防する治療応用に繋がる。
用語解説
注1 Hippo経路:
腫瘍抑制経路の一つであり、MST1/2、LATS1/2のセリンスレオニンキナーゼと、各々の機能を支持するSAV1、MOB1というアダプタータンパクで構成される。LATS1/2はMOB1と協調し、YAP/TAZを直接リン酸化して活性化させる。
注2 YAP/TAZ(Yes-associated protein/transcriptional activator of PDZ domain):
Hippo経路の下流に位置する癌遺伝子である。活性化したHippo経路によりYAP/TAZは高度にリン酸化され、細胞質内に留まりタンパク分解される。Hippo経路が不活性化した場合、YAP/TAZは脱リン酸化されて核内に移行し、転写因子TEADと結合して増殖関連遺伝子であるCTGFなどの転写を促進する。
注3 EGFR(Epithelial Growth Factor Receptor 上皮成長因子受容体):
ERBBファミリー(EGFR, HER2, HER3, HER4がある)に属する受容体型チロシンキナーゼの一つである。EGFなどのリガンドが結合することで二量体を形成して活性化し、下流の様々なシグナル経路を活性化させる。
注4 リガンド:
受容体に結合し、受容体の活性を変化させる因子。例えばEGF(上皮成長因子)はEGFR(上皮成長因子受容体)に結合し、活性化させる。
注5 トランスクリプトーム解析:
RNAシークエンスとその解析により、mRNAの発現を網羅的に解析すること。
論文情報
- 掲載誌: Communications Biology
- 論文タイトル: EGFR Regulates the Hippo Pathway by Promoting the Tyrosine Phosphorylation of MOB1
- 著者名: Toshinori Ando1,2, Nadia Arang1,3, Zhiyong Wang1, Daniela Elena Costea1,4,5, Xiaodong Feng1, Yusuke Goto1, Hiroki Izumi1, Mara Gilardi1, Kazuyo Ando1,6, and J. Silvio Gutkind1,3,*
1. Moores Cancer Center, University of California, San Diego, La Jolla, CA, USA. 2. Graduate school of Biomedical and Health Sciences, Hiroshima University, Japan. 3. Department of Pharmacology, University of California, San Diego, La Jolla, CA, USA. 4. Department of Clinical Medicine and Centre for Cancer Biomarkers CCBio, Faculty of Medicine, University of Bergen, Bergen, Norway. 5. Department of Pathology, Haukeland University Hospital, Bergen, Norway. 6. Department of Orthodontics, Applied Life Sciences, Hiroshima University Institute of Biomedical & Health Sciences, Japan.
* Corresponding author
- DOI: https://doi.org/10.1038/s42003-021-02744-4
【お問い合わせ先】
<研究に関すること>
広島大学病院 口腔検査センター
助教 安藤 俊範
TEL:082-257-5727
FAX:082-257-5727
E-mail:toando19*hiroshima-u.ac.jp
University of California, San Diego Professor J. Silvio Gutkind
E-mail:sgutkind*health.ucsd.edu
<報道(広報)に関すること>
広島大学広報グループ
〒739-8511 東広島市鏡山1-3-2
TEL:082-424-3701
FAX:082-424-6040
E-mail: koho*office.hiroshima-u.ac.jp
(注: *は半角@に置き換えてください)

 Home
Home