広島大学病院 口腔検査センター 講師 安藤俊範
Tel:082-257-5727
E-mail:toando19@hiroshima-u.ac.jp
本研究成果のポイント
- 特定のがん遺伝子とタンパク質が結合することにより、口腔がんが進行してしまい、また抗がん剤にも効きにくくなることを発見しました。
- 口腔がんにも効果を発揮する抗がん剤開発への一助となることが期待されます。
概要
広島大学病院口腔検査センターの安藤俊範講師の率いる研究グループ(口腔検査センター 加治屋幹人 教授、医系科学研究科 口腔腫瘍制御学 柳本惣市 教授、医系科学研究科 口腔顎顔面病理病態学 宮内睦美 元教授との共同研究)は、がん遺伝子のYAPがRNA結合タンパクのRBM39と結合することで、YAPの転写能亢進による増殖促進と、抗がん剤indisulamへの耐性を付与する新たなメカニズムを解明しました。
IndisulamはRBM39を分解することで細胞死を誘導する抗がん剤ですが、口腔がんを含む固形がんは耐性を示すことが問題となっていました。本研究の成果により、indisulamへの耐性獲得を防ぐためには、YAPとRBM39の結合を標的とした薬剤の開発の必要性が示唆されました。
本研究の成果は、ロンドン時間の2024月7月15日午前1時(日本時間2024年7月15日午前9時)に「Oncogenesis」オンライン版(Springer Nature Group)に掲載されました。
論文タイトル
YAP/TAZ interacts with RBM39 to confer resistance against indisulam
著者
Toshinori Ando1,*, Kento Okamoto2, Yume Ueda2, Nanako Kataoka1, Tomoaki Shintani1, Souichi Yanamoto2, Mutsumi Miyauchi3, and Mikihito Kajiya1
1. Center of Oral Clinical Examination, Hiroshima University Hospital, Hiroshima, Japan
2. Department of Oral Oncology, Graduate School of Biomedical and Health Sciences, Hiroshima University, Hiroshima, Japan
3. Department of Oral and Maxillofacial Pathobiology, Graduate School of Biomedical and Health Sciences, Hiroshima University, Hiroshima, Japan
*Corresponding author
掲載雑誌
Oncogenesis (Springer Nature Group)(Q1)
DOI番号
10.1038/s41389-024-00527-0
背景
口腔がんは日本国内で年間約2万人が罹患し、全がんの約2%を占めています。近年では罹患率・死亡率ともに増加傾向にあり、新たな治療薬の開発が望まれています。
口腔がんではがん遺伝子のYAP(注1)が異常に活性化し、がん細胞の増殖を促しています。安藤講師はこれまでに、口腔がんにおけるさまざまな遺伝子異常がYAPの活性化を導くことを明らかにしてきました。しかし、活性化して核内に移行したYAPがどのような分子と結合し、がんの増殖を制御しているかの全貌は未解明でした。
一方、RNA結合タンパクであるRBM39は、遺伝子の発現を促す転写因子の活性化と、発現した遺伝子であるmRNAの正常なスプライシング(注2)を調整する機能を有しています。抗がん剤のindisulam(注3)は、細胞死を引き起こす作用があるため臨床治験が行われましたが、血液がんには効果がある一方で、口腔がんを含む固形がんでは効果が低いことが分かっていました。その後、indisulamはRBM39と結合することでRBM39のタンパク質分解を強制的に誘導し、転写因子の不活性化と、mRNAの異常なスプライシングを誘導することで細胞死を引き起こす機構が明らかになりました。しかし、口腔がんを含む固形がんにindisulamの効果が低い理由については明らかになっていませんでした。
研究成果の内容
安藤講師の率いる研究グループは、口腔がん細胞株を用いて、活性化して核内に移行したYAPが結合している新たなタンパク質を網羅的に探索したところ、これまでに報告のない結合分子としてRBM39を同定しました。
まず研究グループは、RBM39を過剰発現させることで、YAPによる増殖を促す遺伝子の発現が上昇することを見出しました。次に、YAPがRBM39に結合することで、indisulamの作用に影響が出るのではないかと考えました。そこで、口腔がん細胞株でYAPを活性化(注4)させると、indisulamによるRBM39の分解が生じにくくなっていることが分かりました。本来、indisulamが口腔がん細胞に作用してRBM39が分解されると、コラーゲンやインテグリンなどを含む細胞外基質接着に関与するマトリソーム遺伝子の発現が低下し、特定の酵素(FAK)(注5)の活性を低下させることで細胞死が生じます。しかし、YAPが活性化していると、indisulamを投与してもコラーゲンやインテグリンの遺伝子発現が高く保たれており、FAKの活性を抑制できなくなります。さらに、indisulamは口腔がん細胞株の細胞周期やDNA代謝に重要なmRNAのスプライシング異常の一つであるエクソンスキップ(注6)を引き起こすことで、細胞死を誘導します。ところが、YAPが活性化していると、エクソンスキップの発生頻度が低下します(図1)。これらのメカニズムによって、ヌードマウスに口腔がん細胞株を接種した移植モデルにおいても、YAP活性化がindisulamの増殖抑制効果に対して耐性を獲得することが明らかになりました(図2)。
今後の展開
本研究により、口腔がんにおけるYAPとRBM39の結合が、増殖促進とindisulamへの耐性獲得を導くことが明らかになりました。
今後、YAPとRBM39の結合を標的とすることで、indisulamへの耐性を防ぐ新たな薬剤の開発が期待されます。
参考資料
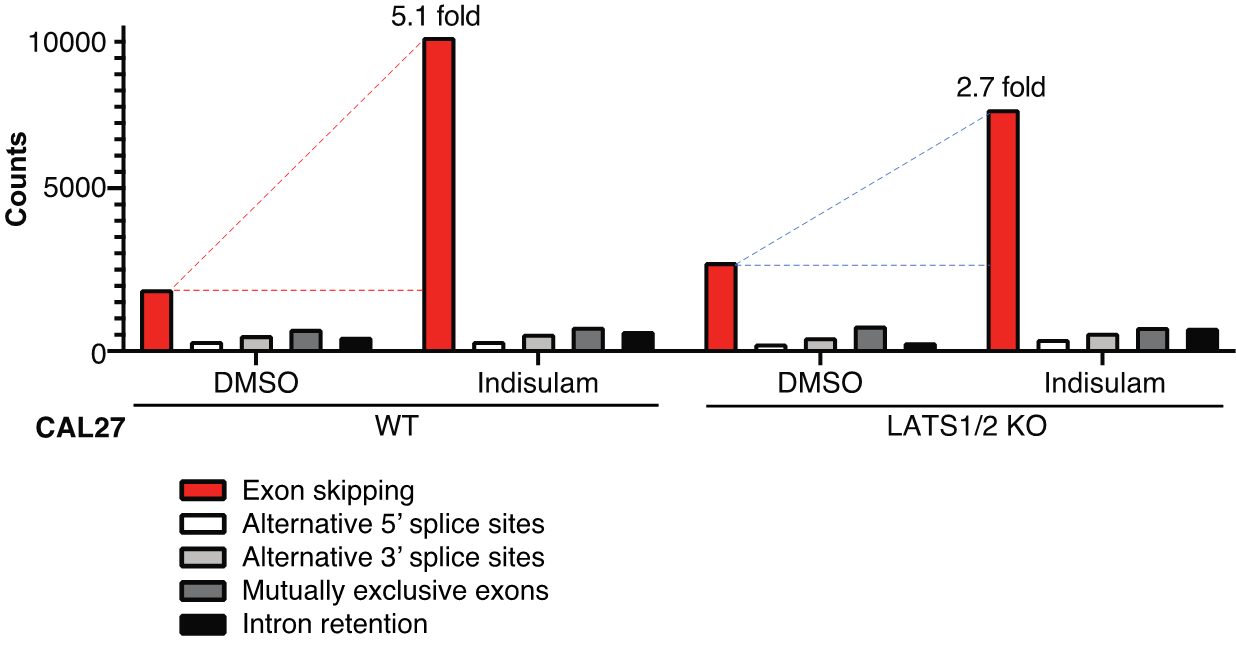
図1 口腔がん細胞株CAL27では、indisulamを投与するとエクソンスキップ(赤色)が5.1倍まで増加するが、YAPを活性化(LATS1/2 KO)させると2.7倍の増加に留まった。
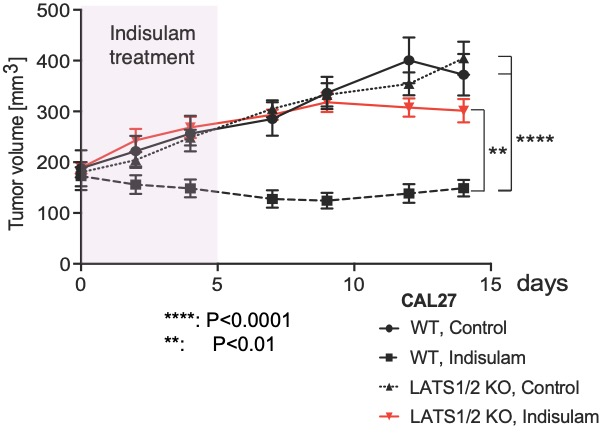
図2 CAL27細胞をヌードマウスの皮下に移植し、腫瘍形成後から5日間indisulamを投与した。Indisulamの投与は腫瘍を縮小させたが(黒四角と点線)、YAPを活性化させた細胞(LATS1/2 KO)では投与後も増大を維持した(赤三角と実線)。
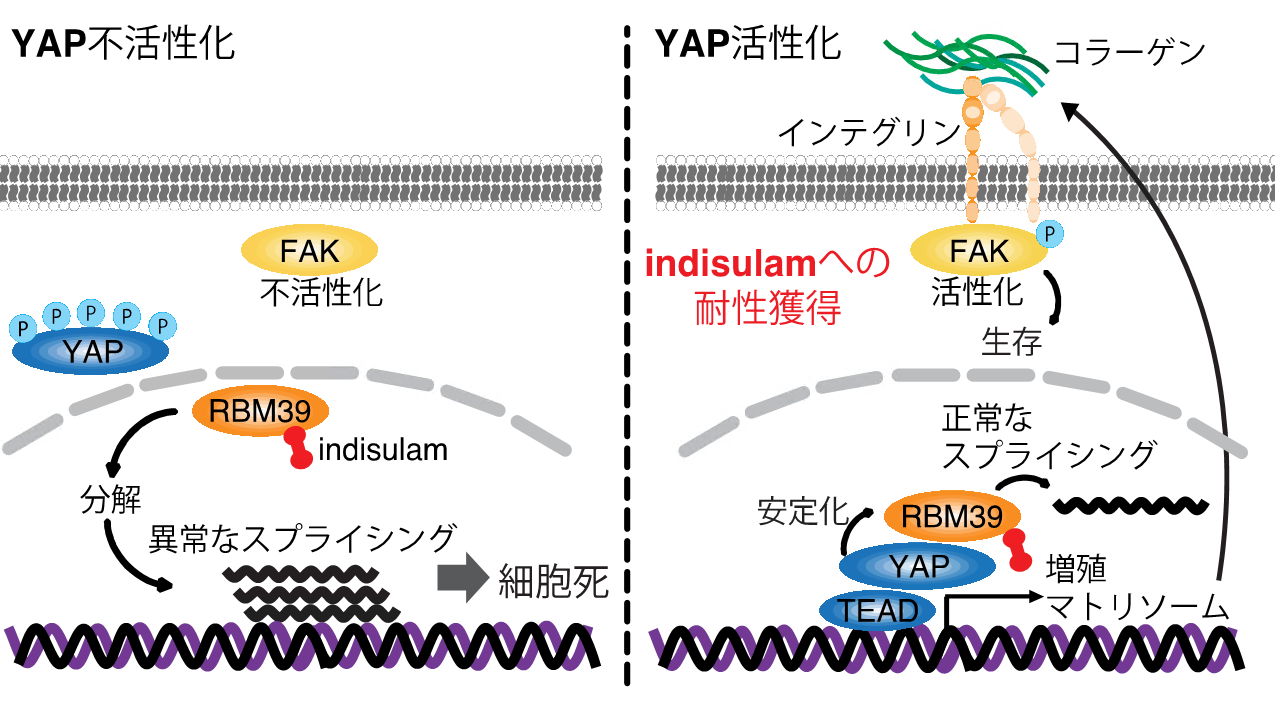
図3 YAPが不活性化した細胞(リン酸化されて細胞質に局在)では、indisulamがRBM39を分解し、異常なスプライシングを引き起こして細胞死へ導く(図の左)。YAPが活性化した細胞(核内に局在し、転写因子のTEADと結合)では、RBM39がYAPと結合し、indisulamを投与してもRBM39の分解が遅延する。RBM39が残っていると増殖およびマトリソーム関連遺伝子の転写を促す。コラーゲンやインテグリンの増加は、FAKの活性化を引き起こし、生存のシグナル経路を活性化する。また、異常なスプライシングが生じなくなるため、細胞死も抑制される。結果的に耐性を獲得する。
補足説明
注1 YAP:Hippoシグナル経路の下流に位置し、細胞の増殖を促進するがん遺伝子である。Hippo経路の構成要素であるLATS1/2が活性化していると、YAPをリン酸化し、細胞質内に局在させるか分解へと導く。一方で、LATS1/2が不活性化していると、脱リン酸化されたYAPは核内に移行し、転写因子のTEADとともに転写を促進する。
注2 スプライシング:DNAから転写されたmRNA前駆体に含まれるタンパク質の合成に不要な部分(イントロン)を取り除き、必要な部分(エクソン)を連結する反応のこと。
注3 indisulam:インドールスルホンアミド化合物の一つ(他にはE7820)である。CUL4ユビキチンリガーゼ複合体の基質認識タンパク質であるDCAF15と結合し、RBM39のユビキチン化を引き起こして分解誘導する。
注4 YAP活性化:Hippo経路の構成要素であるLATS1/2をCRISPR/Cas9を用いたゲノム編集で欠失させることで、YAPが脱リン酸化されて常に核内に留まった状態にしている。
注5 FAK:インテグリンの下流に位置するチロシンキナーゼであり、細胞外マトリクスとインテグリンが接着する際に活性化し、生存に重要な下流シグナルを活性化させる。
注6 エクソンスキップ:最も代表的なスプライシングの異常であり、本来エクソンとして残る部分が除去されて連結されてしまうこと。
- 【プレスリリース】口腔がんへの抗がん剤の耐性を獲得する新たなメカニズムを解明 ~タンパク質の結合がもたらす抗がん剤への耐性~.pdf(429.43 KB)
- 掲載誌:Oncogenesis
- 研究者ガイドブック(安藤 俊範 講師)

 Home
Home



