<研究に関すること>
広島大学原爆放射線医科学研究所 血液・腫瘍内科研究分野
教授 一戸 辰夫
TEL: 082-257-5861
E-mail: nohe*hiroshima-u.ac.jp (注:*は半角@に置き換えてください)
<事業に関すること>
Repertoire Genesis社
事業統括部 市川 満寿夫
TEL: 03-4405-2684
<報道に関すること>
広島大学 財務・総務室広報部広報グループ
西本 勝彦
TEL: 082-424-3701

広島大学原爆放射線医科学研究所の一戸辰夫教授、広島大学大学院統合生命科学研究科の山本卓教授らの研究グループは、山本教授らが開発したゲノム編集ツールである「プラチナTALEN」を利用して、T細胞受容体遺伝子導入T細胞(TCR-T)医薬品の新規創薬技術の開発を進めています。
本技術の臨床応用を実現し、遺伝子改変T細胞療法の恩恵をより多くの国民にもたらすことを目標として、広島大学とRepertoire Genesis社(大阪府茨木市)は2019年0月1日より「次世代ゲノム創薬共同研究講座」を開設しました。このたび同講座で開発を予定している「がん関連抗原NY-ESO-1特異的TCR遺伝子導入T細胞」の製造プロジェクト「NY-ESO-1特異的高機能ゲノム編集T細胞の製造基盤技術の確立」が、国立研究開発法人日本医療研究開発機構(AMED)の令和元年度医療研究開発革新基盤創成事業(CiCLE)に採択されました。
TCR-T医薬品の製造に当たっては、その原料となる患者さんのT細胞がもともと持ってTCR(内在性TCR)と、新たに導入するがん抗原特異的TCRとの干渉現象が課題とされています。一戸教授と山本教授らが開発した技術は、「プラチナTALEN」によるゲノム編集技術を用いてあらかじめ患者さんのTCR遺伝子を非機能化しておき、その後にがん抗原特異的なTCRの遺伝子を導入することで、内在性TCRによる干渉を回避しようとするものです。
今回のAMED事業では、この技術を応用することにより、多くの固形がんや一部の血液がんに発現するNY-ESO-1抗原を認識するTCR-T医薬品を製造する基盤技術を確立することを目標としていてます。
2017年に難治性急性リンパ性白血病に対する世界初のゲノム編集によるCAR-T(キメラ抗原受容体導入T細胞)療法の成功例が報告されて以来、欧米や中国を中心に積極的なゲノム編集T細胞医薬品の開発が進められています。本事業の実現は、わが国初めてのゲノム細胞創薬技術の開発につながることが期待されます。
【採択課題名】
令和元年度AMED医療研究開発革新基盤創成事業(CiCLE)
「NY-ESO-1特異的高機能ゲノム編集T細胞の製造基盤技術の確立」
(研究責任者: 鈴木隆二 ReperToire Genesis社)
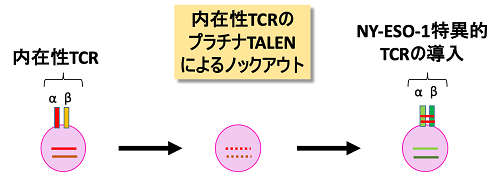
(図1)TCRの抗原結合部位はα鎖とβ鎖の2つのサブユニットで決定されており、それぞれのサブユニットをコードする遺伝子は異なった染色体上に存在する。プラチナTALENを用いることにより、α鎖遺伝子、β鎖遺伝子を段階的に非機能化し、内在性TCRの発現を失ったT細胞にNY-ESO-1特異的なTCR遺伝子を導入する過程の模式図
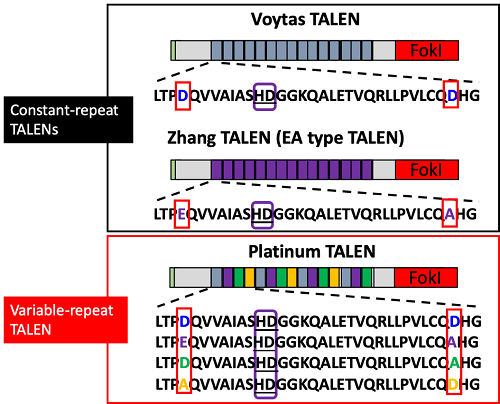
(図2)従来型TALEN(ConsTanT-repeaT TALENs: VoyTas TALEN, Zhang TALEN)とプラチナTALEN(Variable-repeat TALEN)のDNA結合モジュール構造の比較。従来型TALENでは、4番目・32番目のアミノ酸(赤枠)が同一であるのに対し、プラチナTALENでは周期的に変化することにより、高いDNA結合・切断活性を獲得する。なお、TALENはrepeat variable diresidue(RVD)と呼ばれる12番目と13番目のアミノ酸配列(紫枠)の相違により、異なるDNA塩基と結合する(例: 図のHDはシトシンに結合)
(※1) プラチナTALEN
TALエフェクターヌクレアーゼ(TALEN)は植物病原菌XanThomonasに由来するDNA結合タンパクであるTALエフェクター (TALE)と制限酵素Fok Iを組み合わせて作出された人工DNA切断酵素(ヌクレアーゼ)。TALEタンパク質が有するDNA結合領域を標的となる核酸配列に合わせて設計することにより、ゲノム上の所望の配列を切断することができる。プラチナTALENは、TALEタンパク質の34アミノ酸モジュールの4番目と32番目の配列を周期的に変化させることにより、構造上の柔軟性を獲得しており、従来型のTALENより飛躍的に標的ゲノム配列切断活性が高い(図2)。
(※2) T細胞受容体遺伝子導入T細胞(TCR-T)
特定のがん抗原や微生物由来抗原を認識するT細胞受容体(TCR)の遺伝子を、患者あるいは健常人ドナー由来のT細胞に人工的に導入して作出する遺伝子改変型T細胞。T細胞はリンパ球の一種で、α鎖とβ鎖からなるTCRの抗原認識部位を用いてウイルス感染細胞やがん細胞を識別し、それらを殺傷する機能を有する。
(※3) NY-ESO-1
180 アミノ酸残基から成る細胞内タンパク質で、悪性腫瘍および卵巣・精巣以外の正常組織には発現を認めない「がん精巣抗原」のひとつ。悪性黒色腫、滑膜肉腫、食道がん、肺がん、卵巣がん、膀胱がんなどの固形腫瘍や多発性骨髄腫などの血液がんでの発現が知られており、免疫原性が高いことから、多くのがん免疫療法の標的抗原として利用されている。
(※4) 内在性TCRとの干渉現象
T細胞自体が所有するTCR(内在性TCR)の干渉により、新規に導入したTCRが細胞表面に十分に発現できない現象。TCRの細胞表面への発現に必要なCD3分子に2種類のTCRが競合的に結合することや内在性TCRと導入TCRのサブユニットが互い違いに結合する「ミスペアリング」などが原因とされる。
<研究に関すること>
広島大学原爆放射線医科学研究所 血液・腫瘍内科研究分野
教授 一戸 辰夫
TEL: 082-257-5861
E-mail: nohe*hiroshima-u.ac.jp (注:*は半角@に置き換えてください)
<事業に関すること>
Repertoire Genesis社
事業統括部 市川 満寿夫
TEL: 03-4405-2684
<報道に関すること>
広島大学 財務・総務室広報部広報グループ
西本 勝彦
TEL: 082-424-3701
掲載日 : 2020年06月22日
Copyright © 2003- 広島大学