山梨大学医学部小児科学講座の玉井望雅臨床助教と犬飼岳史教授らと、北海道大学病院検査・輸血部の藤澤真一臨床検査副技師長と豊嶋崇徳部長、ワシントン大学医学部(ミズーリ州セントルイス)・発生生物学部門の神元健児研究員および腎臓内科の大町紘平研究員、広島大学・原爆放射線医科学研究所の仲一仁准教授、国立成育医療研究センター・ゲノム医療研究部の要匡部長らの研究グループは、ヒトのがんで最初に同定された染色体異常であるフィラデルフィア染色体を、CRISPR/Cas9によるゲノム編集技術を用いてヒト白血病細胞で人工的に生成することに世界で初めて成功しました。本研究の成果は、Springer Nature 出版のCancer Gene Therapyに、8月23日付けでオンライン掲載されました。
発表内容
【研究の概要】図1参照
白血病をはじめとする種々のがんにおいて、転座と呼ばれる染色体異常がしばしばみられます。染色体転座とは、偶然に途中で切断された別々の染色体部位が入れ替わって再結合することで生じた、異常な染色体を指します。その結果、本来は別々の遺伝子同士が途中で再結合した融合遺伝子が生じる場合があります。融合遺伝子から転写翻訳された融合蛋白質は、がん細胞の生存と増殖を促進することでがんの発症に関与します。染色体転座の研究の歴史は今から約60年前に遡ります。1960年に、Peter Nowell博士とDavid Hungerford博士は慢性骨髄性白血病(Chronic myeloid leukemia: CML)患者の白血病細胞において、正常細胞では認められない微小染色体を発見しました。この微小染色体は研究所のあった場所にちなんでフィラデルフィア染色体と呼ばれるようになりました。フィラデルフィア染色体は、がん細胞で確認された最初の異常な染色体です。1973年に、Janet Rowley博士はフィラデルフィア染色体が9番染色体と22番染色体の転座であることを突き止めました。後に、9番染色体に位置するABL1遺伝子と22番染色体に位置するBCR遺伝子から、転座によって融合遺伝子BCR::ABL1が生じることがわかりました(遺伝子はイタリック体として表記)。フィラデルフィア染色体はCMLのみならず一部の急性リンパ性白血病(Acute lymphoblastic leukemia: ALL)患者の白血病細胞においても認められます。BCR::ABL1から転写翻訳される融合蛋白質BCR::ABL1は、白血病細胞の生存と増殖を持続的に促進することで、白血病の発症に寄与していることが明らかになっています。その結果、BCR::ABL1 の活性を阻害する薬剤(チロシンキナーゼ阻害薬)の開発によって、CMLおよびフィラデルフィア染色体陽性ALLの治療成績は大きく改善しました。その一方で、チロシンキナーゼ阻害薬に対する耐性化の克服などの新たな研究課題が生じています。
以上のように、フィラデルフィア染色体は、9番染色体上のABL1遺伝子と22番染色体上のBCR遺伝子が同時に切断されることで形成されると想定されていますが、その過程を直接に検証した研究はありませんでした。今回、私たちはゲノム編集技術を応用して、ABL1遺伝子とBCR遺伝子を同時に切断することによって、人工的なフィラデルフィア染色体の生成を試みました。ゲノム編集技術は、2012年にEmmanuelle Charpentier博士とJennifer Doudna博士によってCRISPR/Cas9が開発されたことで、幅広い分野に応用することが可能になりました。CRISPR/Cas9を利用すれば、遺伝子上の任意の部位を切断することができます。両博士は2020年にノーベル化学賞を受賞しています。前述のように、フィラデルフィア染色体を獲得した細胞は、自律的に増殖できるようになります。そこで、私たちはヒトのTF-1細胞をモデルに用いて実験を行いました。TF-1細胞は、造血因子(GM-CSF)を添加した培養条件ではフラスコ内で増殖しますが、造血因子を添加しないと増殖できずに死滅してしまいます。TF-1細胞のABL1遺伝子とBCR遺伝子に対してCRISPR/Cas9を作用させた後に、造血因子を添加しない条件で培養したところ、期待通りに自律的に増殖する細胞が得られました。この自律増殖するTF-1細胞において、私たちはフィラデルフィア染色体が形成されていることを確認しました。
フィラデルフィア染色体の発見から60年あまりの時を経て、ゲノム編集技術を応用することで、世界で初めてヒトの細胞において人工的にフィラデルフィア染色体を生成することに成功しました(図1)。この研究成果は、実際にフィラデルフィア染色体が、9番染色体上のABL1遺伝子と22番染色体上のBCR遺伝子が同時に切断されことがきっかけで形成されることを裏付けるものです。また、本研究で樹立した細胞系は、フィラデルフィア染色体陽性白血病の研究や新薬開発のモデル実験系として、今後の研究に寄与するものと期待されます。
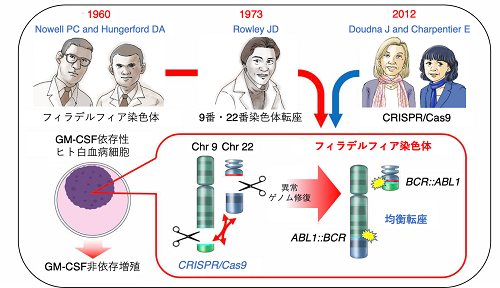
図1:BCR::ABL1を巡る研究の歴史とCRISPR/Cas9技術の融合による本研究内容の模式図
【背景】
遺伝子にはエクソンとイントロンと呼ばれる領域があり、遺伝子からmRNAが転写される際にイントロンは切断され、エクソンが翻訳されてアミノ酸すなわち蛋白質となります。これまでBCR::ABL1のエクソン領域(complementary DNA: cDNA)を細胞に強制発現させることで、融合蛋白質BCR::ABL1の機能解析がなされ、イマチニブなどのチロシンキナーゼ阻害薬が開発されました。しかし、BCR::ABL1陽性白血病の病態解明においてはまだ不明な点があります。これは実際のCML患者でみられるBCR::ABL1をいくつかの点において正確に再現できていないためである可能性があります。まず、3’末端非翻訳領域(3’-untranslated region: 3’-UTR)の関与が挙げられます。3’-UTRは蛋白質へ翻訳されない遺伝子の末端領域であり、3’-UTRにはmicroRNAが結合することで、遺伝子発現が調節される仕組みがあります。BCR::ABL1 cDNAは3’-UTRが欠損しているため、microRNAによる遺伝子発現調節を受けることができません。次に、イントロンの関与が挙げられます。実際のBCR::ABL1ではいくつかのスプライス変異が存在し、BCR::ABL1陽性白血病の病態に関係することが知られています。BCR::ABL1 cDNAによってもたらされる産物は1種類のBCR::ABL1に限定されるためスプライス変異が生じることはありません。さらに、均衡転座としてABL1::BCRが存在することが知られており、このABL1::BCRががん幹細胞の増殖と複製に関与している可能性が報告されています。当然BCR::ABL1 cDNAはBCR::ABL1のみをコードしており、ABL1::BCRがコードされることはありません。これらの点を克服するために、私たちは外来遺伝子としてcDNAを導入する方法に代え、内在する本来のABL1遺伝子とBCR遺伝子からBCR::ABL1を人工的に生み出すことができないかどうか検討しました。そこで注目したのが、2020年にノーベル化学賞を受賞したEmmanuelle Charpentier博士とJennifer Doudna博士によるCRISPR/Cas9でした。CRISPR/Cas9をABL1遺伝子とBCR遺伝子の両遺伝子において作用させ、CRISPR/Cas9により両遺伝子が切断された後、DNAが修復される際にBCR::ABL1が生成されるだろうと考えました。
【方法と結果】
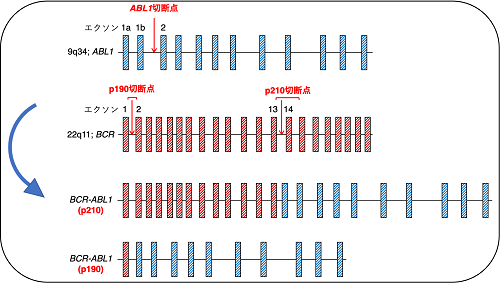
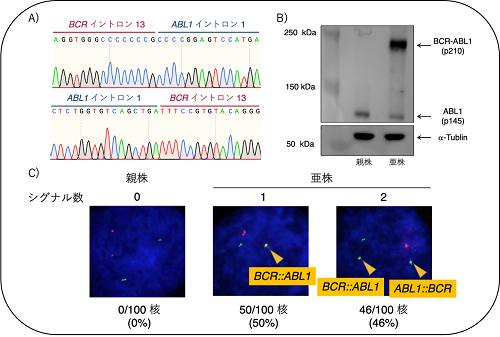
図2に示すように、主にBCR::ABL1にはBCR遺伝子のエクソン13〜15以前またはエクソン2以前と、ABL1遺伝子のエクソン2以降が転座することで生じるp210 BCR::ABL1とp190 BCR::ABL1があります。私たちはヒトの細胞においてp210 BCR::ABL1を生成することを目的として、BCR遺伝子のイントロン13とABL1遺伝子のイントロン1に対してCRISPR/Cas9を作用させる計画を立てました。しかし、ここで一つ問題がありました。実験室で用いられる細胞株は培養容器の中で一定の性質を維持しながら安定的に増殖できる状態になった細胞なので、多くの細胞株はBCR::ABL1の導入の有無によらず増殖してしまうため、BCR::ABL1の導入に成功した細胞だけを選択して取ってくることができません。そこで造血因子GM-CSF依存性に増殖するTF-1という白血病細胞株に着目しました。TF-1においてBCR遺伝子のイントロン13とABL1遺伝子のイントロン1に対してCRISPR/Cas9を作用させ、その後GM-CSF無添加の条件で細胞を培養しました。親株のTF-1はGM-CSF無添加の条件では増殖することができませんが、CRISPR/Cas9を作用させた細胞からはGM-CSF非依存性に増殖する細胞が現れてきました。得られた亜株において、CRISPR/Cas9を作用させたBCR遺伝子とABL1遺伝子の切断点の塩基配列を確認したところ、BCR::ABL1およびABL1::BCRが形成されていることが分かりました(図3A)。また、Western Blot法により亜株においてp210 BCR::ABL1が発現していることを確認しました(図3B)。さらに、Fluorescence in situ hybridization (FISH)法により亜株においてBCR::ABL1の単一シグナルを有する細胞のみならず、均衡転座であるABL1::BCRが同時に形成されている細胞集団も存在していることが分かりました(図3C)。同様にして、BCR遺伝子のイントロン1とABL1遺伝子のイントロン1に対してCRISPR/Cas9を作用させたTF-1からはp190 BCR::ABL1を獲得した亜株を樹立することができました。これらの亜株は親株にはみられないチロシンキナーゼ阻害薬(イマチニブ・ニロチニブ・ダサチニブ・ポナチニブ)に対する感受性も示しました。
【まとめ】
これまで半世紀以上かけて数多くの研究者によってBCR::ABL1陽性白血病の病態は解明され、治療法が開発されてきました。今回私たちはBCR::ABL1 cDNAの持つウィークポイントを克服し、CRISPR/Cas9の力を借りてBCR::ABL1陽性白血病研究の新たなステージを切り開きました。本研究において樹立されたp210およびp190 BCR::ABL1亜株はBCR::ABL1陽性白血病のさらなる詳細な研究における有用なリソースとなる可能性があります。また造血幹細胞において本手法を用いることで、これまで再現することが困難であったBCR::ABL1陽性CMLの発症モデルが樹立できる可能性があります。
【要点】
- CRISPR/Cas9を用いることでを用いることで内在する遺伝子より内在する遺伝子より人工的に人工的にBCR::ABL1を生成することに成功しました。
- p210およびおよびp190 BCR::ABL1陽性白血病細胞株の樹立に成功しました。
- 本技術によって、本技術によって、BCR::ABL1陽性白血病の病態解明における新たな研究基盤が築かれました。
用語解説
- 転写翻訳:遺伝子からmRNAが作られ、mRNAの情報をもとにして蛋白質合成が行われること
- 9および22番染色体:ヒトには22対の常染色体と2本の性染色体があり、大きい方から順に番号を付けて呼ばれている。
- チロシンキナーゼ:蛋白質のチロシン残基にリン酸基を付加する酵素であり、細胞増殖などのスイッチとして機能する。
- GM-CSF:Granulocyte-macrophage colony stimulation factorという造血細胞の成長促進因子
- エクソンとイントロン:遺伝情報がコードされている部分をエクソン、遺伝情報がコードされていない部分をイントロンという。
- 造血幹細胞:血液細胞の元となる細胞のこと
- microRNA:遺伝子の機能調節に関わる20〜25塩基の微小RNA
- スプライス変異:イントロンが切断されてmRNAが成熟する過程において、イントロンの一部が挿入されたり、一部のエクソンが読み飛ばされたり(エクソンスキップ)することで一様でないmRNAが生じること
- p210およびp190 BCR::ABL1:蛋白質の分子量の違いによる呼称
- Western Blot法:抗体を用いて蛋白質の発現量を評価することができる。親株と亜株で共通に発現する-Tublinの発現量をもとにして目的の蛋白質の発現量を比較している。
- Fluorescence in situ hybridization (FISH)法:特定の遺伝子領域を蛍光標識する手法
図2:BCR:ABL1の模式図(矢印は本研究におけるCRISPR/Cas9の作用点)
図3:A)亜株におけるBCR::ABL1およびABL1::BCRの結合部位の塩基配列 B)Western Blot法によるp210 BCR::ABL1蛋白質の発現解析 C) Fluorescence in situ hybridization (FISH)法によるBCR::ABL1とABL1::BCRの形成(赤:ABL1遺伝子、緑:BCR遺伝子)
謝辞
図1のイラストはイラストレーター・鈴木律子様(https://ritsukomobo.wixsite.com/mannenhiyoko)より頂きました。また本研究はJSPS科研費JP21K15528・JP19K08833・JP19H03615の助成を受けたものです。
論文情報
- 掲載誌:Cancer Gene Therapy
- 論文タイトル:Creation of Philadelphia chromosome by CRISPR/Cas9-mediated double cleavages on BCR and ABL1 genes as a model for initial event in leukemogenesis
- 著者:Minori Tamai,1 Shinichi Fujisawa,2 Thao T.T. Nguyen,1 Chiaki Komatsu,1 Keiko Kagami,1 Kenji Kamimoto,3 Kohei Omachi,4 Shin Kasai,1 Daisuke Harama,1 Atsushi Watanabe,1 Koshi Akahane,1 Kumiko Goi,1 Kazuhito Naka,5 Tadashi Kaname,6 Takanori Teshima,2 and Takeshi Inukai1
1. 山梨大学医学部小児科学講座
2. 北海道大学病院検査・輸血部
3. Department of Developmental Biology, Washington University School of Medicine in St. Louis
4. Division of Nephrology, Washington University School of Medicine in St. Louis
5. 広島大学・原爆放射線医科学研究所
6. 国立成育医療研究センター・ゲノム医療研究部
- 掲載URL:https://doi.org/10.1038/s41417-022-00522-w
- 掲載日時:2022年8月23日
【お問い合わせ先】
<研究に関すること>
山梨大学医学部小児科学講座 臨床助教臨床助教
玉井 望雅(たまい みのり)
E-mail: tamaim*yamanashi.ac.jp
<報道に関すること>
山梨大学 企画部広報企画課
TEL: 055-220-8005,8006
E-mail: koho*yamanashi.ac.jp
北海道大学病院 総務課総務係
TEL: 011-706-7631
E-mail: pr_office*huhp.hokudai.ac.jp
広島大学 広報室
TEL: 082-424-3701
E-mail: koho*office.hiroshima-u.ac.jp
国立成育医療研究センター 広報企画室
TEL:03-3416-0181(代表)
E-mail: koho*ncchd.go.jp
(注: *は半角@に置き換えてください)


 Home
Home