がんの増殖・転移を抑制
『がん細胞に老化を誘導し、がんの増殖・転移を抑制できるヒトの体内にある小さな核酸・マイクロRNA を発見!』
本研究成果のポイント
- 細胞老化を誘導できるマイクロRNA としてmiR-22 を同定しました。
- miR-22 が、乳がんや子宮頸がん細胞に細胞老化を誘導して、癌の増殖・転移を抑制することを明らかにしました。
- miR-22 による細胞老化誘導のメカニズムとして、これまでに老化誘導のシグナルとして知られる重要な分子の複数を標的にして機能していることを明らかにしました。
- 生体内に存在するマイクロRNA を用いて、「老化」という生物学的に重要な機構を調節できることを示した発見で、特に、miR-22 は、がん細胞で失われた老化を誘導するプログラムを修復して、癌を抑制できる画期的な発見です。
- miR-22 は、生体内にある天然物の核酸なので、これまでの抗がん剤のような副作用、抗がん剤耐性などのリスクが極めて低く、次世代の核酸医薬品開発につながるものとして期待されます。
なおこの研究成果は、国際的な米国科学学術誌Journal of Cell Biology の2011年4月18日号オンライン版(http://jcb.rupress.org/)に掲載されます。
■記載雑誌:J. Cell Biol. 2011 193 (2)
■論文タイトル:miR-22 represses cancer progression by inducing cellular senescence
(邦訳:miR-22は、細胞老化を誘導してがんの進展を抑制する)
■著者:徐丹、竹下文隆、日野由美子、福永早央里、工藤保誠、玉置彩、松永純子、高橋陵宇、高田隆、嶋本顥、落谷孝広、田原栄俊
概略
広島大学大学院医歯薬学総合研究科 田原栄俊教授、徐丹研究員らを中心とする研究グループは、生体内にある小さな核酸の一つマイクロRNA(miR-22)を用いて、がん細胞に老化を誘導して腫瘍の増殖および転移を抑制できることを明らかにしました。
これまで、ヒト由来の天然型の抗がん剤はほとんど知られていませんが、今回の研究成果はヒトの生体内で作られる小さな核酸(マイクロRNA)が、乳がんや子宮がんに細胞老化を誘導して、がんの増殖や転移を抑制することを発見したものです。高転移性の乳癌がん細胞をマウスに移植した腫瘍に、今回発見したマイクロRNA22(miR-22)を投与すると、腫瘍の増殖を顕著に抑制し、転移も抑制することができました(国立がん研究センター落谷孝広らとの共同研究)。これまでの抗がん剤は、細胞死を誘導して効果を示すものがほとんどですが、がん細胞に老化を誘導させて癌を抑制する治療法が有効であることを示せた今回の成果は、次世代の抗がん剤の新しい治療法となる可能性があります。マイクロRNAは、ヒトの生体内に存在する天然物ですので、これまでの抗がん剤治療の問題点である、抗がん剤の大きな副作用、抗がん剤耐性の問題、膨大な治療費の問題など多くの問題点を克服できる可能性を持っています。特に、抗がん剤治療における患者のQOLを大幅に改善できる可能性を秘めています。本研究によりがん治療にマイクロRNAを用いることができる成果であり、次世代の抗がん剤として核酸医薬品の開発が加速されることが期待されます。
研究背景と目的
マイクロRNA(miRNA)は、ゲノムから転写される20-25塩基の非常に短いノンコーディングRNA(タンパク質をコードしていないRNA)の一つであり、動植物に広く存在し、細胞の発生、分化、増殖などの様々な生物現象に重要な役割を果たしています(図1)。miRNAは、ゲノムDNA から転写後にプロセッシングを経て成熟した機能性分子となり、メッセンジャーRNA の翻訳阻害、転写の阻害、メッセンジャーRNA の分解などに機能することが知られています(図2)。これまでの研究は、DNA からメッセンジャーRNA そしてタンパク質が作られる過程に焦点を当てた研究が主流でしたが、タンパク質をコードしていないmiRNA が、これらの制御に重要な機能を果たしていることがわかってきました。miRNA は、siRNAと異なり一つのmiRNAで約100以上もの遺伝子を標的にしており、細胞内の遺伝子調節の新機構として近年世界中で注目されています(Nature 455, 64-67, 2008)。つまり、miRNA は、一つの遺伝子を阻害するのではなく、複数の遺伝子を一度に阻害して生物学的に重要なネットワークを阻害すると考えられています。特に、癌のみならず様々な疾患においてmiRNA の発現が増減し、それが疾患の発症に関わる重要な遺伝子群の調節に関わっていることも明らかになりました。このようなmiRNA の発現変化は、病気の診断、予後診断などに応用されようとしています。治療では、減少しているmiRNA の補充をする治療法、増加しているmiRNA を減らす治療法などが試みられています。しかし、これまでにがん細胞に老化を誘導して治療を行おうとする研究はあまり知られていませんでした。
生体内において、老化細胞は、悪性度の高い癌組織では見つかりませんが、前癌病変領域には、多数存在していることが知られています。これは、前癌細胞に癌遺伝子の活性化による老化誘導(Oncogene induced senescence)により老化が誘導されたもので、癌の重要ながん抑制機構として機能していることが明らかになっています(Narita, M.,and S.W. Lowe. 2005. Senescence comes of age. Nat Med. 11:920-922.)。そこで、我々は、老化を誘導するmiRNAが存在すれば、強力ながん抑制機構として機能し、次世代の核酸医薬を用いた抗癌剤治療に貢献できるものと考え、本研究を実施しました。
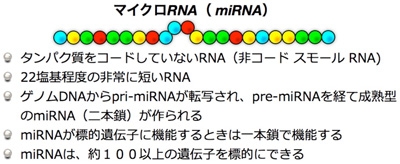
図1マイクロRNA の構造
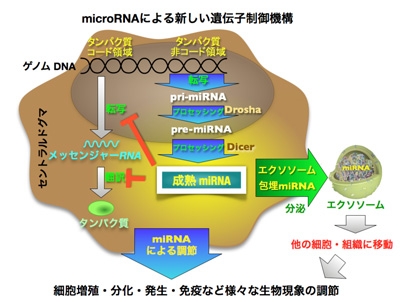
図2マイクロRNA の生合成
主要な研究成果・意義
1.miR-22 は、in vitro の細胞老化で発現が増加し、細胞老化を誘導する機能がある。
ヒトの正常な繊維芽細胞は、細胞分裂に限界(寿命)があり、ある一定の回数で分裂停止して二度と分裂することのできない老化細胞になります。老化研究のモデル系としてよく使われていますが、この老化で発現が変化するマイクロRNA をマイクロアレイ解析により網羅的に解析しました。その結果、老化で増加するマイクロRNA を複数同定することができました。そのうちの一つが、今回の研究成果のmiR-22 です。miR-22 を若い正常な繊維芽細胞に導入すると、細胞老化のマーカーとして知られている老化特異的ベータガラクトシダーゼ(SA-β-gal)や老化関連ヘテロクロマチンフォーカス(SAHF)がみられ、老化細胞の特徴である細胞の巨大化と扁平化が起こりました(図3)。この結果は、miR-22 がヒトの細胞老化の過程で重要な役割をしていることを示しています。
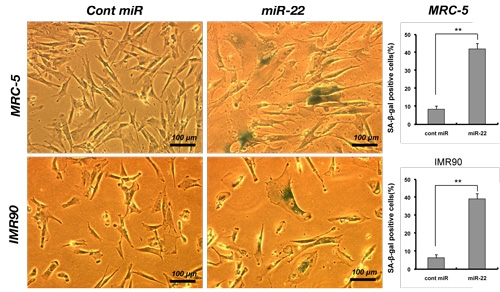
図3:miR-22 によるヒト繊維芽細胞の細胞老化誘導
Cont miR:コントロール(比較対照群)、miR-22:miR-22 を導入した細胞群
上段がMRC-5 繊維芽細胞、下段がIMR90 細胞
グラフは、老化特異的ベータガラクトシダーゼ陽性率(緑色陽性率)
2.がん細胞にmiR-22 を補充すると、細胞老化を誘導することができる。
miR-22 の発現をリアルタイムPCR により増幅して調べてみると、多くのがん細胞でmiR-22 の発現が大幅に低下していることが明らかになりました(図4)。正常細胞と比較すると顕著な発現低下であり、がん細胞ではmiR-22 の機能が失われている可能性が考えられました。
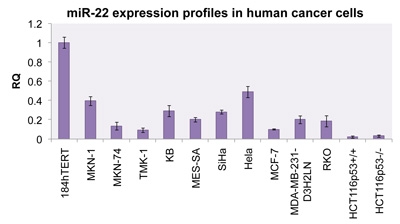
図4:がん細胞株におけるmiR-22 の発現
184hTERT は正常乳腺上皮細胞、その他はがん細胞
miR-22 が発現低下している乳がん細胞や子宮頸がん細胞などに、miR-22 を導入すると細胞の巨大化および扁平化がおこり細胞増殖が抑制されました(図5)。これらの細胞は、細胞老化のマーカーとして知られている老化特異的ベータガラクトシダーゼ(SAβ-gal)や老化関連ヘテロクロマチンフォーカス(SAHF)を示したことから、がん細胞に老化が誘導されていることがわかりました(図6)。
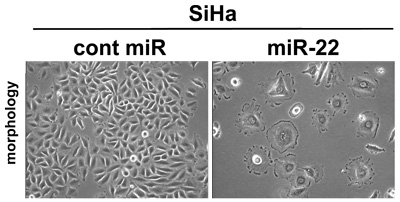
図5:miR-22 による子宮頸がん細胞(SiHa)の老化誘導(細胞の巨大・扁平化)
写真はいずれも同倍率で撮影したものです。
Cont miR:コントロール(比較対照群)、miR-22:miR-22 を導入した細胞群
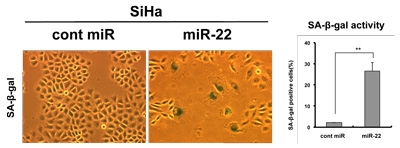
図6:miR-22 による子宮頸がん細胞(SiHa)の老化誘導(老化マーカ-)
写真はいずれも同倍率で撮影したものです。
Cont miR:コントロール(比較対照群)、miR-22:miR-22 を導入した細胞群
3.miR-22 は、細胞老化誘導シグナルの重要な経路を複数阻害する。
細胞老化は、癌抑制遺伝子として知られるp53 やpRB が重要な役割を果たしていることが知られています。我々は、miR-22 が、これらの経路に関わる遺伝子であるSIRT1、CDK6、SP1 を標的遺伝子としていることを突き止めました。つまり、miR-22 単独で、少なくとも3つの老化に関連する遺伝子を阻害することを明らかにしました(図7)。
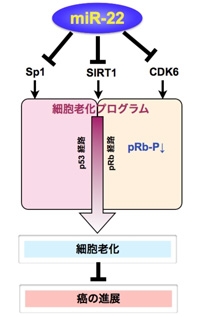
図7:miR-22 の標的遺伝子は細胞シグナルに関与した遺伝子群である
老化で増加しているmiRNA は、多くのがん細胞で減少していることが明らかになりました。それらのmiRNA の多くは、がん細胞の増殖を抑制する機能があるmiRNA でした。逆に、がん細胞で高発現しているmiRNA の一部は、老化細胞で発現が下がっていることがわかりました。つまり、老化で高発現しているmiRNAは、癌の抑制に働いている可能性があることが明らかになりました(図8)。
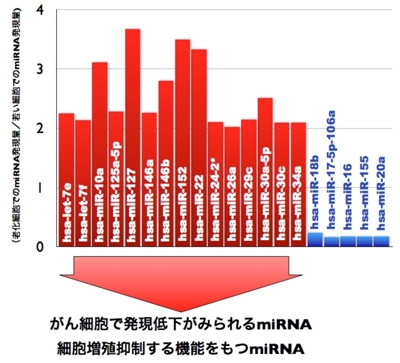
図8:老化で発現するmiRNA は、がん細胞で顕著に低下している
4.がん細胞へのmiR-22 の投与による細胞老化誘導は、がん細胞の増殖能力だけでなく、運動能、浸潤能も阻害する。
転移性のがん細胞は、異常な増殖能のほかに浸潤能、遊走能が亢進しています。転移性の高いがん細胞にmiR-22 を導入して、浸潤能、遊走能をそれぞれInvasion assay および創傷治癒アッセイで測定したところ、miR-22 はいずれも抑制することがわかりました。細胞の運動の変化をビデオカメラで撮影した実験結果からも、miR-22 を強制発現して扁平で大きくなったがん細胞が、miR-22 を入れていないがん細胞に比べて細胞の遊走能が低くなっていることが明らかになりました。これらの結果は、老化という表現系が、増殖のみならず細胞の浸潤能や遊走性の性質も抑制しうるという結果であり、老化を誘導することによる癌の進行を多面的に抑制する可能性を示すことができました。
5.乳がんの高転移モデルマウスを用いたin vivo での評価では、miR-22 の投与により原発巣の顕著な腫瘍の抑制とともに転移も抑制する。
乳がんの高転移がん細胞であるMDA-MB-231-luc-D3H2LN 細胞を、スキッドマウスに移植して約2週間で腫瘍を形成してから、miR-22 を2日おきに皮下投与しました。そして、約1ヶ月後に原発巣の大きさおよび各臓器の転移の度合いを測定しました。その結果、miR-22 は原発巣での乳がん腫瘍の増殖を顕著に抑制しました(図9)。また、肝臓、腎臓、脾臓、小腸、胃の各臓器において顕著に転移を抑制しました(図10)。miR-22 を投与した腫瘍では、老化マーカーのSA-β-gal 染色陽性(緑色)を示しました(図11)。以上の結果は、miR-22 が腫瘍に老化を誘導することで顕著に腫瘍の増殖および転移を抑制することができ、miR-22 が抗腫瘍核酸医薬品として有望であることが示されました。
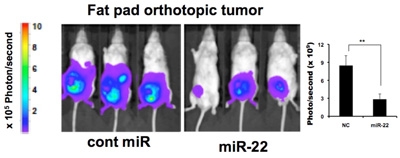
図9:乳がん転移モデルマウスの原発巣におけるmiR-22 の腫瘍抑制効果
Cont miR:コントロール(比較対照群)、miR-22:miR-22 を投与した群
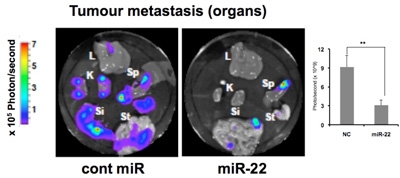
図10:乳がん転移モデルマウスの転移巣におけるmiR-22 の転移抑制効果
Cont miR:コントロール(比較対照群)、miR-22:miR-22 を投与した群
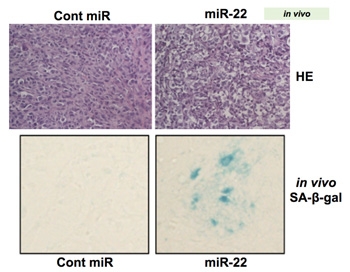
図11:乳がん転移モデルマウスの原発巣におけるmiR-22 による老化誘導
Cont miR:コントロール(比較対照群)、miR-22:miR-22 を投与した群
今後の展望
細胞老化を誘導するがん治療は、これまで実用化された例はなく、これまでの細胞死を誘導するがん治療と異なる画期的な治療に結びつく可能性を秘めています。特に、ヒトの身体の中に存在するマイクロRNA を用いたがん治療は、副作用の大幅な低下、抗がん剤耐性の問題、医療費の大幅な削減およびがん患者の抗がん剤治療におけるQOL の向上につながることが期待できます。今後、miR-22 を抗がん剤として核酸医薬品化に向けて製薬企業や関連企業と協力して開発していきたいと考えています。また、乳がん患者や子宮がん患者では、腫瘍でのmiR-22 の発現低下が広く起こっている可能性があります。その為、miR-22 を癌診断や予後診断のマーカーになる可能性が考えられることから、診断マーカーとしての研究も推進します。特に、近年マイクロRNA は血中に存在していることが明らかになっていますので、血液サンプルを用いた診断システムも開発する予定です。
特記事項
本研究は、以下の研究費により行われた研究成果です。

文部科学省科学研究費新学術領域研究
がん研究分野の特性等を踏まえた支援活動


 Home
Home





