(問い合わせ先)
広島大学 大学院理学研究科 数理分子生命理学専攻
山本 卓(ヤマモトタカシ)
TEL:0824-24-7446 FAX:0824-24-7498
(報道担当)
広島大学 学術・社会産学連携室 広報グループ
多賀 信政(たが のぶまさ)
TEL:082-424-6017 FAX:082-424-6040
独立行政法人理化学研究所 広報室 報道担当
TEL:048-467-9272 FAX:048-462-4715
平成24年6月15日
国立大学法人広島大学
独立行政法人理化学研究所
遺伝子を自由に切り貼りできる新しい人工酵素を使い、生きた胚での1細胞レベルでの遺伝子発現の可視化に成功
広島大学(浅原利正学長)、理化学研究所(野依良治理事長)は、人工酵素である人工ヌクレアーゼ注1)を用いてウニ初期胚の標的遺伝子中にGFP遺伝子注2)を挿入し、内在遺伝子発現量を1細胞単位で定量化することに成功しました。これは、広島大学理学研究科数理分子生命理学専攻(山本卓教授)、原爆放射線医科学研究所・ゲノム障害医学研究センター(松浦伸也教授)、理化学研究所発生・再生科学総合研究センター フィジカルバイオロジー研究ユニット(柴田達夫ユニットリーダー)の共同研究の成果です。
人工ヌクレアーゼの1つであるジンクフィンガーヌクレアーゼ(ZFN)注3)には、細胞内の標的遺伝子を切断・改変することができる特徴があります。ZFNを使うことによって、動物や植物、培養細胞において高効率に遺伝子改変できることが報告されています。しかし、ZFNの設計や作製が難しいことからその利用が広がっておらず、加えてZFNを使った遺伝子挿入については一部のモデル生物で報告されているだけでした。
研究グループは、独自の方法で目的の遺伝子を改変するZFNを設計・作製し、このZFNを利用して、オワンクラゲの緑色蛍光タンパク質(GFP)の遺伝子をウニゲノム中のHpEts1遺伝子注4)へ挿入することに成功しました。さらに、ウニ胚発生過程においてGFP蛍光を定量的に解析することによって、幼生骨片をつくる同じ細胞種であっても、HpEts1遺伝子の発現量は細胞によってばらつきがあることを明らかにしました。
今回、ZFNを使うことよって、いままで成功例の報告がないウニ初期胚に、目的とする遺伝子座へ外来遺伝子の挿入が成功したことは、これまで目的の遺伝子のみを改変することが困難であった生物種においても遺伝子破壊や遺伝子挿入の可能性が示され、人工ヌクレアーゼを用いた基礎研究および応用研究の道が開かれると期待されます。
本研究成果は、「米国科学アカデミー紀要(PNAS)」のオンライン速報版で平成24年6月18日の週に公開されます。
近年、様々な生物種において標的遺伝子を改変する技術として、人工ヌクレアーゼのZFNを利用した“ゲノム編集注5)”が注目されています。ZFNは、約3塩基を認識するジンクフィンガーを3~6個連結したジンクフィンガーアレイをDNA結合ドメインとしてもつ人工ヌクレアーゼです。2つの人工ヌクレアーゼが近接する標的配列に結合すると二量体を形成し、二本鎖DNAを切断します。切断されたDNAは、相同組換えあるいは非相同末端連結により修復されますが、この時に目的の遺伝子を改変することが可能となります。この技術は、標的配列の選択が可能であることから次世代の遺伝子技術として注目されており、ゼブラフィッシュ、マウス、ラット、ウニなどの動物やシロイヌナズナなどの植物、哺乳類培養細胞(ES細胞、iPS細胞を含む)において遺伝子改変の成功例が報告されていました。しかし、ZFNの作製に高額な費用を要することから、広く利用されるに至っていないのが現状です。加えて、外来遺伝子を挿入する遺伝子挿入技術はマウスなど限られたモデル生物種においてのみ報告されていました。
研究グル―プは、ウニの幼生骨片の分化に関わる転写因子HpEts1遺伝子に着目し、この遺伝子を改変するZFNを大腸菌のone-hybridスクリーニングとヒト培養細胞を用いたsingle-strand annealing(SSA)を組み合せた方法によって作製しました(図1)。作製したZFNのゲノムDNAの切断活性を確認した後に、ZFNとドナー構築(オワンクラゲのGFP遺伝子の両端にHpEts1遺伝子の相同領域をもつDNA)をウニ卵に顕微注入したところ、相同組換えによってGFP遺伝子をHpEts1遺伝子座へ挿入できることが確認されました(図2)。加えて、非相同末端連結修復に必要なDNAリガーゼ4の機能抑制とドナー構築の細胞内での直鎖化によって、GFP遺伝子の挿入効率を上昇させることに成功しました。
さらに、HpEts1遺伝子座へGFP遺伝子を挿入したウニ胚を発生させ、1細胞単位で蛍光を定量化したところ、HpEts1遺伝子の発現は幼生骨片を作り出す一次間充織細胞において量的な違い(ばらつき)があることが明らかになりました(図3)。この結果は、これまで使われていた遺伝子発現量の検出方法では明らかになっておらず、人工ヌクレアーゼを用いて挿入したGFP遺伝子のライブイメージング注6)の有効性を示すことに成功しました。
人工ヌクレアーゼを利用した遺伝子改変と遺伝子挿入が様々な生物や培養細胞で利用可能となれば、基礎研究のみならず応用研究で高い利用価値が期待されます。例えば、ES細胞やiPS細胞において、疾患関連遺伝子を破壊したり修正したりすることが可能になります。作物や家畜であれば有用な性質をもった品種を短期間に作製することも将来可能になるかもしれません。
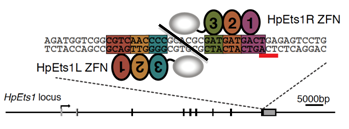
図1 HpEts1遺伝子を切断するジンクフィンガーヌクレアーゼ(ZFN)の設計・作製
1〜3の丸はジンクフィンガーを示し、灰色の丸はヌクレアーゼを示す。
四角で囲んだHpEts1遺伝子の塩基配列に対するZFNを設計・作製した。
赤線は終始コドンを示す。1組のZFNが標的配列に結合するとDNA二本
鎖切断が誘導される。
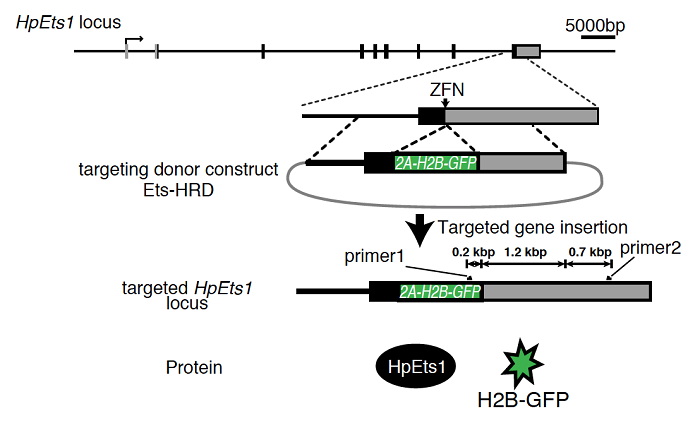
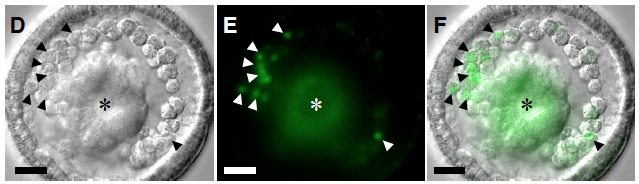
図2 ZFNとドナー構築を用いたGFP遺伝子の挿入
ZFNとドナー構築を共導入することによって2A-H2B-GFPカセットが
HpEts1遺伝子座へ挿入される。その結果、HpEts1とH2B-GFPが同量
発現するので、GFP蛍光からHpEts1の発現量を調べることができる。
幼生骨片を作る間充織細胞(写真の矢頭)でGFP蛍光が観察出来る。アスタ
リスクは原腸を示し、非特異的な蛍光が見られる。
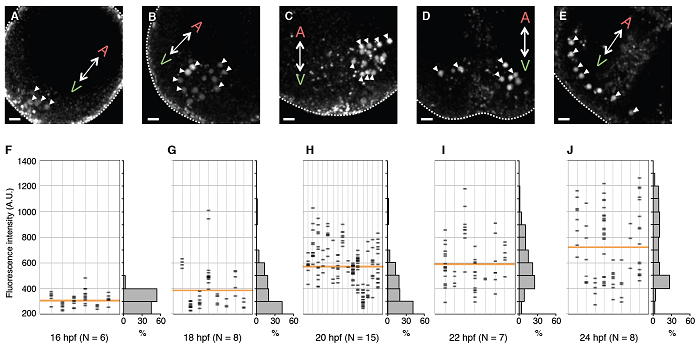
図3 HpEts1遺伝子座へGFP遺伝子を挿入したウニ胚での1細胞レベルでの蛍光
強度の測定
胚ごとのGFP蛍光を細胞レベルで測定した結果、受精後18時間の胚からHpEts1遺伝子の発現のばらつきが大きくなることがわかった。黄色の横線はGFPの平均強度を示している。矢頭がGFP蛍光を発する間充織細胞。上段のウニ胚の写真中、赤字Aは動物極側、緑字Vは植物極側であることを示している。
〈論文名〉
“Zinc-finger nuclease-mediated targeted insertion of reporter genes for quantitative imaging of gene expression in sea urchin embryos"
(ウニ胚における遺伝子発現の定量的イメージングのためのジンクフィンガーヌクレアーゼを介した標的遺伝子へのレポーター遺伝子の挿入)
著者:落合 博(広島大学大学院理学研究科、現広島大学原爆放射線医科科学研究所 助教)
坂本尚昭(広島大学大学院理学研究科 准教授)
藤田和将(広島大学大学院理学研究科 博士課程学生)
西川正俊(理化学研究所発生・再生科学総合研究センター 研究員)
鈴木賢一(愛媛大学沿岸環境科学研究センター 研究員)
松浦伸也(広島大学原爆放射線医科学研究所 教授)
宮本達雄(広島大学原爆放射線医科学研究所 助教)
佐久間哲史(広島大学大学院理学研究科 研究員)
柴田達夫(理化学研究所発生・再生科学総合研究センター ユニットリーダー)
山本 卓(広島大学大学院理学研究科 教授)
(問い合わせ先)
広島大学 大学院理学研究科 数理分子生命理学専攻
山本 卓(ヤマモトタカシ)
TEL:0824-24-7446 FAX:0824-24-7498
(報道担当)
広島大学 学術・社会産学連携室 広報グループ
多賀 信政(たが のぶまさ)
TEL:082-424-6017 FAX:082-424-6040
独立行政法人理化学研究所 広報室 報道担当
TEL:048-467-9272 FAX:048-462-4715
注1)人工ヌクレアーゼ:
目的とする遺伝子のみを特異的に切断する人工的に作製可能な酵素。DNAに結合する部分とDNA切断に働く部分 から構成されるキメラタンパク質。
注2)GFP遺伝子:
下村脩博士が発見したオワンクラゲからクローニングされた緑色蛍光タンパク質の遺伝子。この遺伝子から作られるGFPタンパク質は緑色の蛍光を発する。
注3)ジンクフィンガーヌクレアーゼ(ZFN):
zinc-finger nuclease。DNAに結合する部分に亜鉛を含むジンクフィンガーを使っており、DNA切断に働く部分に細菌の制限酵素FokIのヌクレアーゼを使っている。
注4)HpEts1遺伝子:
ウニの幼生骨片を作る細胞に発現する転写因子遺伝子。ウニ胚において、この遺伝子を発現した細胞は、全て骨を作る細胞の運命に変わる。
注5)ゲノム編集:
人工ヌクレアーゼによってゲノムDNAに二本鎖DNA切断を誘導し、その修復過程において、標的遺伝子へ欠失や挿入変異を導入したり、ドナー構築を用いた相同組換えによって遺伝子を改変する技術。
注6)ライブイメージング
細胞や組織を生きたまま観察する技術。
Copyright © 2003- 広島大学