(問い合わせ先)
広島大学 大学院理学研究科 数理分子生命理学専攻
山本 卓(ヤマモトタカシ)
TEL:0824-24-7446 FAX:0824-24-7498
(報道担当)
広島大学 学術・社会産学連携室 広報グループ
多賀 信政(たが のぶまさ)
TEL:082-424-6017 FAX:082-424-6040
平成25年2月8日
人工酵素TALエフェクターヌクレアーゼ(TALEN)を使い、効率的にラットの遺伝子を改変することに成功
本研究成果のポイント
- 遺伝子の改変を行なうために新しい人工酵素TALエフェクターヌクレアーゼ(TALEN)を作製する技術を開発しました。
- 作製したTALENを用いて、ラット線維芽細胞で色素合成に関与するチロシナーゼ遺伝子に突然変異を導入することができました。
- 作製したTALENとDNAの末端を分解する酵素をラット受精卵へ顕微注入することによって、チロシナーゼ遺伝子が破壊されたアルビノラットの作製に成功しました。
広島大学(浅原利正学長)は、第二世代の人工ヌクレアーゼ注1)を用いてラットの遺伝子を効率的に改変することに成功しました。これは、広島大学大学院理学研究科数理分子生命理学専攻(山本卓教授)と京都大学大学院医学研究科附属動物実験施設(真下知士特定准教授)の共同研究の成果です。
人工ヌクレアーゼは、DNAに結合する部分とDNAの切断に働く部分から構成されるキメラタンパク質で、細胞内の標的遺伝子を切断・改変することができる特徴があります。これまでは、第一世代の人工ヌクレアーゼであるジンクフィンガーヌクレアーゼ(ZFN)注2)を利用し、動物や植物、培養細胞において高効率に遺伝子改変できることが報告されています。共同研究者の京都大学の真下特定准教授らは、ZFNをラット受精卵に導入することにより、免疫不全ラットの作製に成功してきました(Mashimo et al., PLoS ONE, 2010)。しかし、ZFNの設計や作製が難しいこと、受託作製では高額な作製が必要なことからその利用が広がっていないのが現状でした。
最近、TALエフェクターヌクレアーゼ(TALEN)注3)という第二世代の人工ヌクレアーゼが、ZFN同様の遺伝子改変技術ができることで注目を集めています。研究グループは、TALENを短期間で作製する独自のシステムを開発し、様々な生物(メダカ、カエル、ホヤ、ラットなど)での効果を調べてきました(Sakuma et al., Genes to Cells, 2013)。今回、ラット遺伝子を標的とするTALENを独自のシステムによって作製し、効率的に目的の遺伝子のみを破壊したラット(ノックアウトラット)を作製することに成功しました。
本研究成果は、Nature Publishing Group (NPG)オープンアクセス誌「Scientific Reports」で平成25年2月13日(日本時間)に公開されます。
研究の背景
近年、様々な生物種において標的遺伝子を改変する技術として、人工ヌクレアーゼを利用した“ゲノム編集注4)”が注目されています。人工ヌクレアーゼは、DNAに特異的に結合するドメインとDNAを切断するドメインからなる人工の酵素です。2つの人工ヌクレアーゼが近接する標的配列に結合すると二量体を形成し、二本鎖DNAを切断します。切断されたDNAは、相同組換えあるいは非相同末端連結により修復されますが、この時に目的の遺伝子を改変することが可能となります。この技術は、標的配列の選択が可能であることから次世代の遺伝子技術として注目されており、ゼブラフィッシュ、マウス、ラット、ウニなどの動物やシロイヌナズナなどの植物、哺乳類培養細胞(ES細胞、iPS細胞を含む)において遺伝子改変の成功例が報告されていました。しかし、第一世代の人工ヌクレアーゼは、作製に高額な費用を要することから、広く利用されるに至っていないのが現状です。
研究の内容
京都大学の真下知士特定准教授らとの共同研究により、ラットチロシナーゼ(Tyr)遺伝子を標的とするTALENを独自に作製しました(図1)。Tyrは、メラニン色素の合成に関わる遺伝子で、動物では遺伝子が変異あるいは欠損すると体毛や皮膚が白くなる色素欠乏症、いわゆるアルビノになります。作製したTALENをラット線維芽細胞(Rat-1)に導入することで、Rat-1細胞内のTyr遺伝子に数~数十bpの遺伝子変異を導入することができました(図2)。さらに、DNA鎖の5'末端から分解する酵素エキソヌクレアーゼ(Exo1)発現ベクターをTALENと共導入すると、遺伝子変異率が上昇しました。
次に、ラット受精卵にTALENと Exo1 のmRNAを顕微注入により導入して、2細胞期胚からDNAを抽出して遺伝子変異を確認しました(図3)。TALEN 単独の場合(5.6%)と比べて、Exo1はラット受精卵でもTALENによる遺伝子変異導入率(28.6%)を上昇しました。さらに、TALENと Exo1のmRNAを顕微注入したラット受精卵から、Tyr遺伝子ノックアウトラット(アルビノ)を効率的に作製することに成功しました(図4)。
今後の期待
京都大学との共同研究により、独自に作製したTALENを利用することで、日本では初めてラットチロシナーゼ遺伝子を欠損したノックアウトラットを作製することに成功しました。エキソヌクレアーゼ(Exo1)をTALENと一緒にラット受精卵に導入することで、ラット細胞、あるいはラット受精卵で遺伝子変異効率を大幅に上昇させることができました。従来の遺伝子改変マウス・ラットを作製する際に利用されるES細胞技術と比べても、今回の技術は非常に効率的な技術であるといえます。また、マウス、ラットだけでなく、ウサギ、ブタ、ウシ、サルなどの中大動物にも利用できるため、今後、実験動物や家畜におけるゲノム編集技術が大きく発展すると期待します。
参考図
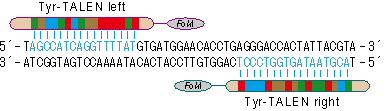
図1 ラットチロシナーゼ(Tyr)遺伝子を標的としたTALエフェクターヌクレアーゼ(TALEN)
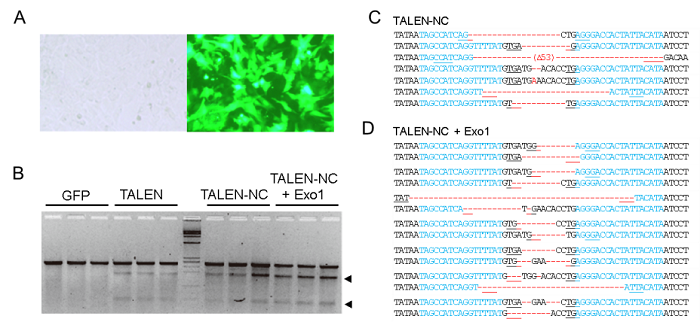
図2(A)ラット線維芽細胞(Rat-1)とGFPを導入したRat-1細胞(B)変異解析法により確認された遺伝子変異、Exo1共発現により遺伝子変異導入率が上昇(C、D)シークエンス法により確認された遺伝子変異
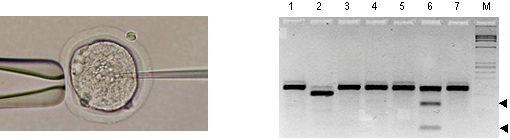
図3 ラット受精卵へ顕微注入法によりTALENを導入(左)、変異解析法により確認された遺伝子変異(右)

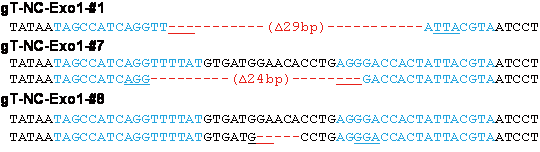
図4 ラットTyr遺伝子を欠損して全身が真白になったアルビノラット(Tyrノックアウトラット)と導入された変異
掲載論文
雑誌名
Scientific Reports(NPGオープンアクセス誌)
論文名
Efficient gene targeting by TAL effector nucleases coinjected with exonucleases in zygotes
TALエフェクターヌクレアーゼとエキソヌクレアーゼの共導入による受精卵での効果的遺伝子改変
著者名
Tomoji Mashimo1*, Takehito Kaneko1, Tetsushi Sakuma2, Junya Kobayashi3, Yayoi Kunihiro1, Birger Voigt1, Takashi Yamamoto2, Tadao Serikawa1
真下 知士1、金子武人1、佐久間哲史2、小林 純也3、国広 弥生1、Voigt Birger1、山本 卓2、芹川忠夫1
著者所属機関名
1 Institute of Laboratory Animals, Graduate School of Medicine, Kyoto University
2 Department of Mathematical and Life Sciences, Graduate School of Science, Hiroshima University
3 Genome Repair Dynamics, Radiation Biology Center, Kyoto University
1 京都大学大学院医学研究科附属動物実験施設
2 広島大学大学院理学研究科数理分子生命理学専攻
3 京都大学放射線生物研究センターゲノム動態研究部門
用語解説
注1)人工ヌクレアーゼ:
目的とする遺伝子のみを特異的に切断する人工的に作製可能な酵素。DNAに結合する部分とDNA切断に働く部分から構成されるキメラタンパク質。
注2)ジンクフィンガーヌクレアーゼ(ZFN):
zinc-finger nuclease。DNAに結合する部分に亜鉛を含むジンクフィンガーを使っており、DNA切断に働く部分に細菌の制限酵素FokIのヌクレアーゼドメインを使っている。
注3)TALエフェクターヌクレアーゼ(TALEN):
transcription activator-like effector nuclease。と植物の病原細菌であるXanthomonas(キサントモナス)から発見されたDNA結合蛋白TALEとDNA切断ドメインFokIを融合させた人工酵素。
注4)ゲノム編集:
人工ヌクレアーゼによってゲノムDNAに二本鎖DNA切断を誘導し、その修復過程において、標的遺伝子へ欠失や挿入変異を導入したり、ドナー構築を用いた相同組換えによって遺伝子を改変する技術。

 Home
Home





