広島大学原爆放射線医科学研究所
教授 松浦 伸也(まつうらしんや)
TEL: 082-257-5809
E-mail: shinya*hiroshima-u.ac.jp
(E-mailの*は半角@に置き換えてください。)
平成25年12月12日
染色体の数を守るがん抑制遺伝子の調節スイッチを発見
本研究成果のポイント
- 染色体の数を守るBUBR1(バブアール・ワン)遺伝子を調節するスイッチを発見し、このスイッチの異常が高発がん性遺伝病の原因であることを解明
- 人工ヌクレアーゼを用いて、ゲノム上の特定の一塩基だけを操作する技術(一塩基編集法)を開発
広島大学原爆放射線医科学研究所の松浦伸也教授を中心とする研究グループ(同大学大学院理学研究科の山本卓教授、医歯薬保健学研究院の工藤美樹教授、新潟県立がんセンター新潟病院の浅見恵子医師、梶井正山口大学名誉教授ら)は、次世代シーケンサー(※1)によるゲノム解読技術と、独自に開発した人工ヌクレアーゼ(※2)を利用した一塩基編集法(※3)を組み合わせて、がん抑制遺伝子BUBR1を調節するスイッチを発見し、このスイッチの異常が染色体数の乱れを特徴とする高発がん性遺伝病(染色分体早期解離症候群)の原因であることを解明しました。本研究成果は、平成25年12月17日午前5時(日本時間)米国科学アカデミー紀要Proceedings of the National Academy of Sciences(略称PNAS)オンライン版に掲載されます。
論文名:"TALEN-mediated single-base-pair editing identification of an intergenic mutation upstream of BUB1B as causative of PCS (MVA) syndrome"
著 者:Hiroshi Ochiai1, Tatsuo Miyamoto1, Akinori Kanai, Kosuke Hosoba, Tetsushi Sakuma, Yoshiki Kudo, Keiko Asami, Atsushi Ogawa, Akihiro Watanabe, Tadashi Kajii, Takashi Yamamoto, Shinya Matsuura2
1equal contribution(共同筆頭著者)
2corresponding author(責任著者)
なお、本論文はPNAS誌巻頭で注目論文(This Week in PNAS)として取り上げられる予定です。
背景
染色分体早期解離(premature chromatid separation:PCS)症候群は、染色体の数が生まれつき不安定になっている遺伝病で、ウィルムス腫瘍や横紋筋肉腫などの小児がんが多発する難病です。ヒトの細胞が分裂して増えるとき、親細胞の染色体は次世代の娘細胞へ正確に46本ずつ受け渡されます。この正確性は、分裂中の細胞に正しい染色体の数をモニターするシステム(分裂期チェックポイント)が備わっているためです。BUBR1遺伝子はこの染色体数監視システムの中核を担っていますが、PCS症候群ではBUBR1遺伝子の異常によりこの監視システムが破綻しており、親細胞の染色分体(次世代の細胞の染色体)が早期に分離して(図1)、娘細胞に不均等に分配されます。そのため細胞が分裂するたびに染色体の過剰や喪失が生じて、がんを多発します。
研究成果
PCS症候群の一部の患児のBUBR1遺伝子には、変異は見られないがBUBR1タンパク質量が低下しているタイプが知られていました。そこで、このBUBR1遺伝子とその周辺領域約20万塩基を、次世代シーケンサーを用いて詳しく調べました。その結果、BUBR1遺伝子から上流側に約4万4千塩基離れた場所に病気と関連する塩基の変化(一塩基置換)を見出しました(図2)。この塩基変化をヒト培養細胞に、独自に開発した一塩基編集法を用いて導入したところ、患者細胞と同様にBUBR1タンパク質量が低下して染色分体の早期解離と染色体数の乱れが生じました(図3)。一般に、遺伝子DNAはタンパク質の設計図として働いており、DNAはRNAに転写され、RNAはタンパク質に翻訳されて、タンパク質として実際の生命機能を発揮します。それぞれの遺伝子には、細胞内にどの程度のタンパク質量を供給するかを調節するスイッチ(転写調節領域)が存在することが知られています。本研究によって、同定した塩基変化の部分がBUBR1遺伝子のスイッチ(転写調節領域)として機能しており、このスイッチの異常がPCS症候群の原因であることがわかりました(図4)。
今後の展開
染色体の数や構造の異常は、放射線被ばく者や一般の人のがんでしばしば見られます。したがって本研究成果は、PCS症候群のみならず、広範ながんの診断法や治療法の開発に結びつく可能性があります。
最近、病気や体質に関連した一塩基多様性(※4)が多数報告されており、オーダーメイド医療や創薬シーズの学術的基盤として注目されています。しかし、これらの一塩基多様性が実際の病気や体質にどのように影響を与えるかそのメカニズムについては不明な点が多いのが現状です。本研究で開発した一塩基編集法は、一塩基多様性の機能を調べる新しい手法として、今後広く利用されると期待されます。
参考資料
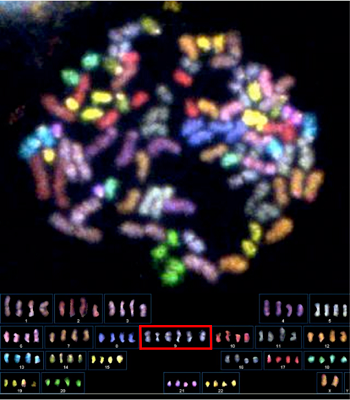
図1.PCS症候群患児のリンパ球の染色体マルチカラーFISH画像。すべての染色分体が分離した染色分体早期解離(PCS)と染色体数の乱れ(9番染色体のトリソミー、赤のボックスで示した部分)が見られる。
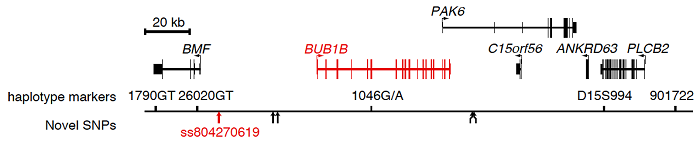
図2.BUBR1遺伝子(BUB1B)とその周辺領域の遺伝子地図。BUBR1遺伝子から上流側に約4万4千塩基離れた場所にグアニンからアデニンへの一塩基置換(ss804270619)を見出した。
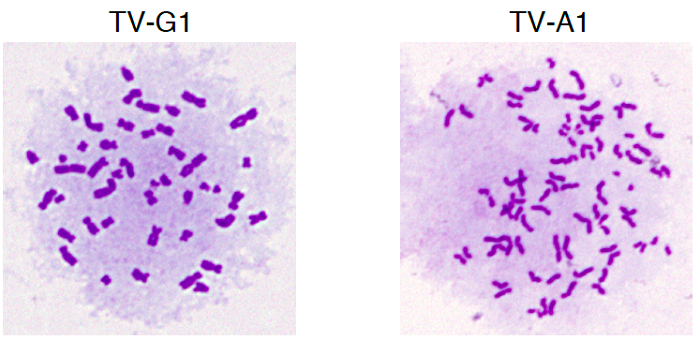
図3.一塩基置換を人工的に導入した細胞クローンTV-A1は、染色分体早期解離(PCS)を示した。TV-G1はコントロール細胞。

図4. 本研究で同定した塩基変化の部分がBUBR1遺伝子のスイッチ(転写調節領域)として機能しており、このスイッチの異常がBUBR1タンパク質量の減少、すなわちPCS症候群の原因であることを見出した。
用語説明
※1 次世代シーケンサー
従来のキャピラリー法とは異なった新しい原理を用いた塩基配列の決定のための実験機器。ランダムに切断された多数のDNA断片を同時並行的に解析することで、短期間に膨大なゲノム塩基配列を決定することができる。
※2 人工ヌクレアーゼ
ゲノム上の特定の塩基配列を切断する人工制限酵素。
※3 一塩基編集法
培養細胞または初期胚のゲノム塩基配列のうち、1つの塩基のみを改変するゲノム編集技術。人工ヌクレアーゼの開発により高効率のゲノム編集が可能となってきた。
※4 一塩基多様性
1人1人が持つゲノムDNA中の一塩基の違い。病気のかかりやすさや体質などの個人差に関連すると考えられている。

 Home
Home





