広島大学 学術・社会産学連携室広報グループ 久保田 真理子
TEL:082-424-6781 FAX:082-424-6040
平成26年1月22日
無血清培養条件下での効率的な人工多能性幹細胞(iPS)の樹立および維持方法を発見
本研究成果の要旨
広島大学(浅原利正学長)は、ヒトiPS細胞をフィーダー細胞を用いずに、無血清培地のみを用いて、歯髄細胞や線維芽細胞からヒトiPS細胞の樹立、およびその未分化性と多分化能の長期維持に成功しました。
これは、広島大学病院 顎・口腔外科(山崎佐知子診療医)、広島大学大学院医歯薬保健学研究院(岡本哲治教授)らの研究成果です。
ヒトiPS細胞は一般的にフィーダー細胞上で、血清を10%程度添加した培養液中で樹立・培養されており、ロット差による不安定性や異種抗原や感染性因子の混入等の不定要素により、各種制御因子の同定、比較検討、医療応用は困難でした。
本研究では、フィーダー細胞を用いず、無血清培地を用いて、歯髄細胞や線維芽細胞からヒトiPS細胞の樹立を行い、さらにその未分化性と多分化能の長期維持にtransforming growth factor-β1(TGF-β1)が重要な役割をしていることを明らかにしました。
この研究成果は米科学雑誌PLOS ONE(オンライン版)に2014年1月29日(米国東部標準時)付けで掲載されます。
研究の背景
発生生物学や再生医学研究、創薬・疾患研究の分野において、胚性幹細胞(embryonic stem cell : ES細胞)1)や人工多能性幹細胞(induced pluripotent stem cell :iPS細胞)2) が注目されています。幹細胞は自己複製能と多分化能を有する細胞であり、様々な細胞系列へと分化する能力を持ちます。2006年に京都大学の山中伸弥教授らがマウスiPS細胞の樹立を報告して以来、受精卵を用いるという倫理問題の残るES細胞の代替手段として、大きな注目を浴びています。iPS細胞は誘導多能性幹細胞とも訳され、皮膚などの最終分化した細胞に、ウイルスやプラスミドベクター3)等を用いて初期化遺伝子(Oct3/4, Sox2, Klf4, c-Mycなど)を導入し、リプログラム4)させることで、様々な細胞種へ分化可能な万能細胞となります。
これら幹細胞は、一般的に血清あるいは動物由来成分を含む代替血清添加培地を用い、不活性化したマウス胎児線維芽細胞(Mouse Embryonic Fibroblast : MEF)などのフィーダー細胞5)をディッシュ上に増やし、それを支持細胞として培養されています。そのため、ES/iPS細胞の継代6)の際にはできるだけフィーダー細胞とES/iPS細胞を分離する必要があります。
また、ES/iPS細胞のみならず、フィーダー細胞の調整も必要なため、大変煩雑な操作が必要で、用いるフィーダー細胞の、種類や処理の仕方、ロット差も大きく、幹細胞の状態がかなり左右されるため、安定した条件で培養することは出来ませんでした。さらに、牛血清あるいは動物由来成分を含む代替血清が添加されているため、未知の成分の存在や、病原体混入の可能性もあり、常に一定条件での培養は困難でした。また、フィーダー細胞として用いるマウス細胞由来因子も混入するため、再生医療への臨床応用を考慮すると安全性が問題となっていました。
このような不定要素が多い条件で培養された幹細胞では、組織・臓器発生や再生などの、基礎研究の標準化が困難で、未分化性の維持に必要な増殖因子・分化誘導因子の機能を比較検討する事や、特定の細胞へ分化誘導することも困難でした。
そこで私たちはこれらの問題点を克服するためには、組成の明らかな培養条件による培養法の標準化が必要と考え、本研究では、無血清培養条件下で初代培養を行った歯髄細胞から、フィーダー細胞を用いないで、全組成の明らかな無血清培地を用いて、ヒトiPS細胞の誘導・樹立、さらにその未分化性と多分化能を長期間継代維持可能な無血清単層培養系の確立を目指しました。
研究の内容
本研究では、我々が開発・報告した、全組成が明らかな無血清培地(RD6F, hESF9)を用いて、ヒト歯髄由来細胞の初代培養から、初期化遺伝子導入、ヒトiPS細胞樹立、さらにその長期継代培養の全過程を完全無血清培養系にて行うことに成功しました。
1. ヒト歯髄由来細胞からのフィーダー細胞を用いない無血清培養条件下でのiPS細胞誘導
歯髄由来細胞(DPCs)は、インフォームドコンセントの後、健常人抜去智歯より採取した歯髄組織より無血清培地RD6Fを用いて分離・培養しました。続いて、同DPCsに初期化4遺伝子(Oct3/4, Sox2, Klf4, c-Mycなど)を導入し、初代培養から初期化遺伝子導入、ヒトiPS細胞誘導までの全過程を、フィーダー細胞を用いないで、完全無血清培養系にて行いました(図1-A)。感染(初期化遺伝子導入)20日後のコロニー7)を回収し、フィブロネクチン(fibronectin)コートディッシュ上に播種し、無血清培地hESF9にて誘導・培養を行ったところ、本無血清培養系では高いiPS細胞への誘導効率を示しました(図1-B,C)。
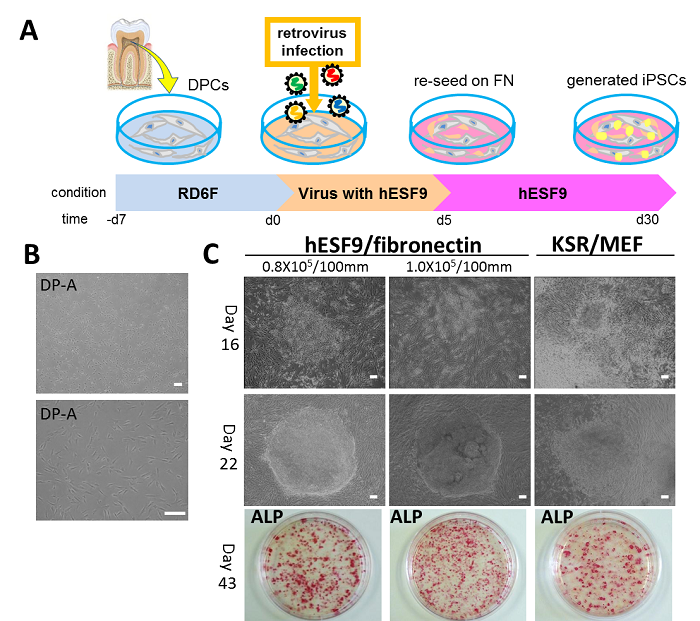
図1 無血清培地およびフィーダー細胞を用いない培養条件下での歯髄由来細胞(DPCs)を用いたヒトiPS細胞の誘導
A) ヒトiPS細胞誘導の概略図
B) 初期化遺伝子導入前の歯髄細胞の位相差顕微鏡像
C) 無血清培養条件下にてウイルス感染により歯髄由来細胞へ初期化遺伝子を導入しフィブロネクチンコートディッシュ上で培養した。下段に感染43日後のALP染色像を示す。誘導効率は0.23-0.38%と比較的高効率であった。KSR/MEFは、ヒトES細胞用血清添加培地を使用しフィーダー細胞上で維持したhiPS細胞の位相差顕微鏡像およびALP染色像を示す。Bars indicate 200 μm
2. ヒトiPS細胞の増殖能および未分化性の維持に及ぼすtransforming growth factor-β1(TGF-β1)の影響
歯髄由来細胞から樹立したヒトiPS細胞を回収後、無血清培地hESF9あるいはhESF9にTGF-β1を添加したhESF9T培地を用いて、フィブロネクチンコートしたディッシュ上に播種しました。無血清培地hESF9で維持したヒトiPS細胞は、長期間の継代培養に伴い、その未分化性を十分に維持することは困難になりましたが、hESF9にTGF-β1を添加した無血清培地hESF9Tで維持したヒトiPS細胞は、未分化性を維持したまま80代以上の長期間に渡り継代培養することが可能でした(図2-A)。
また、hESF9培地に種々の濃度のTGF-β1を添加し、遺伝子発現解析を行ったところ、TGF-β1の濃度依存的に未分化性を保持した細胞数は増加し、未分化マーカー遺伝子の発現が増加しましたが、分化マーカー遺伝子の発現は低下しました(図2-B)。無血清培地hESF9を用いることで、短期間は未分化性を維持したヒトiPS細胞の継代・維持が可能でしたが、TGF-β1を添加したhESF9Tで培養することで、未分化性と多分化能を維持した細胞の長期継代・維持が可能となることが示されました(図3)。
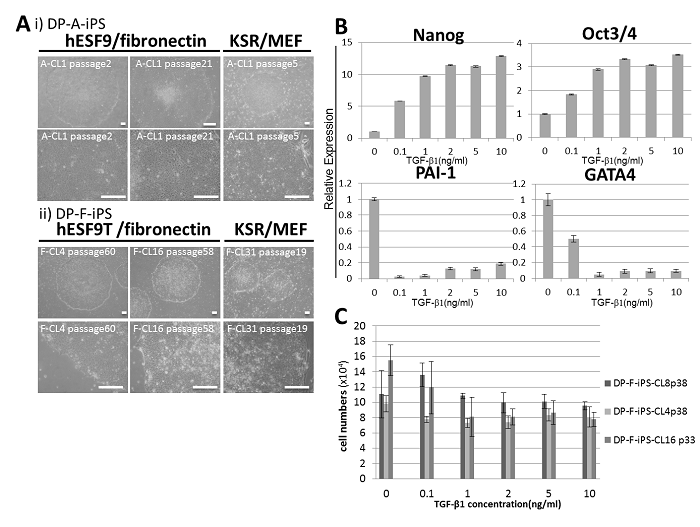
図2 無血清培養条件下でのiPS細胞の未分化性および多分化能に及ぼすTGF-β1の影響
A) フィーダー細胞を用いない無血清培地hESF9を用いた培養条件下で歯髄由来細胞から誘導したヒトiPS細胞を、無血清培地hESF9(DP-A-iPS)あるいはhESF9にTGF-β1を添加したhESF9T(DP-F-iPS)を用いて、フィブロネクチンコートディッシュ上で維持したヒトiPS細胞の位相差像。なお、AのKSR/MEFは、ヒトES細胞用血清添加培地を使用しフィーダー細胞上で維持したhiPS細胞の位相差顕微鏡像を示す。Bars indicate 200 μm
B) TGF-β1のヒトiPS細胞の遺伝子発現に及ぼす影響
無血清培養条件で維持したヒトiPS細胞に、各種濃度のTGF-β1を添加し、未分化マーカー遺伝子および分化マーカー遺伝子の発現に及ぼす影響について解析した結果、未分化マーカー遺伝子NanogおよびOct3/4遺伝子は濃度依存的に上昇したが、分化マーカー遺伝子PAI-1およびGATA-4遺伝子発現は低下した。
C) hiPS細胞の増殖に及ぼすTGF-β1の影響
TGF-β1添加hESF9T培地にて33〜38代継代維持したhiPS細胞を、種々の濃度のTGF-β1存在下でさらに培養し、細胞増殖に及ぼす影響を解析した。Bars represent the mean ± SEM. (n=3)
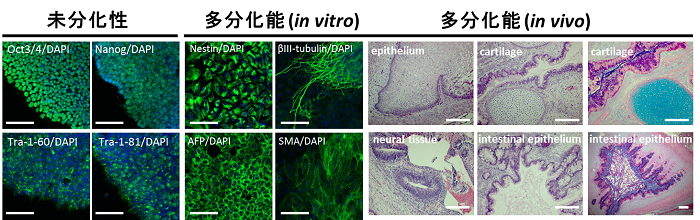
図3 無血清培養条件下にて誘導・維持したヒトiPS細胞の未分化性と多分化能のin vitroおよびin vivoでの解析
hESF9T培地で培養・維持しているhiPS細胞における未分化マーカー蛋白の発現を、蛍光免疫染色により検討した結果、Oct3/4、Nanog、Tra-1-60およびTra-1-81の発現を認めた(未分化性)。一方、in vitroの系を用いて、胚様体形成による分化誘導を行い、胚様体における各種分化マーカー蛋白の発現を蛍光免疫染色で検討した結果、神経細胞(Nestin, βIII-tubulin)、肝臓細胞(α-fetoprotein: AFP)、筋肉細胞(smooth muscle actin: SMA)への分化を認めた(多分化能 (in vitro))。Bar indicates 100μm
また、無血清培養条件下にて継代・維持したヒトiPS細胞を、免疫不全マウスの背部皮下へ移植したところ、三胚葉の混在した組織であるテラトーマ8)を形成した。テラトーマ組織内に、上皮組織、軟骨組織、神経組織、腸管組織などへの分化像を認めた(多分化能 (in vivo))。
(H-E染色あるいはAlcian Blue染色像を示す)Bar indicates 200μm
今後の期待
一般的に、ES細胞やiPS細胞などの幹細胞は、フィーダー細胞や血清などの動物由来成分を含む条件で培養されています。このような培養系では各種異種抗原の混入の恐れがあり、再生医療への応用は困難でした。さらにこれら幹細胞の増殖・分化制御機構やその制御因子を明らかにすることも非常に困難でした。
本研究の結果、歯随由来細胞の初代および継代培養を、RD6F無血清培地を用いて行い、さらにhESF9培地を用いてフィーダー細胞を用いずに歯髄由来細胞からヒトiPS細胞を誘導し、80代以上の長期間に渡り、同細胞の未分化性と多分化能を維持したまま継代培養が可能であることが明らかになりました。
本無血清培養系は、成分の明らかな既知の因子のみから成るため、幹細胞の未分性の維持や増殖・分化を制御する各種因子の同定や検討が容易となり、発生・組織・臓器再生メカニズムの解明や、創薬スクリーニングへの応用、さらに安全で確実な再生医療の実現が可能となると考えられます。
掲載論文
雑誌名:学術雑誌PLOS ONE(オンライン版) (オープンアクセス論文)
論文名:Generation of human induced pluripotent stem (iPS) cells in serum- and feeder-free defined culture and TGF-β1 regulation of pluripotency
日本語論文名:フィーダー細胞を用いない完全無血清培養系でのヒト人工多能性幹細胞の樹立と維持、およびトランスフォーミング成長因子?β1による未分化性の制御
著者名:
Sachiko YAMASAKI 1, Yuki TAGUCHI 1, Akira SHIMAMOTO 2, Hanae MUKASA 1, Hidetoshi TAHARA 2, Tetsuji OKAMOTO 1*
山崎佐知子1, 田口有紀1, 嶋本顕2, 向笠英恵1, 田原栄俊2, 岡本哲治1
著者所属機関名:
1 Department of Molecular Oral Medicine and Maxillofacial Surgery, Applied Life Sciences, Graduate Institute of Biomedical & Health Sciences, Hiroshima University
2 Department of Cellular and Molecular Biology, Basic Life Sciences, Graduate Institute of Biomedical & Health Sciences, Hiroshima University
1 広島大学大学院医歯薬保健学研究院応用生命科学部門分子口腔医学顎・顔面外科学
2 広島大学大学院医歯薬保健学研究院基礎生命科学部門細胞分子生物学
用語解説
1) 人工多能性幹細胞(iPS 細胞:induced pluripotent stem cell)
体細胞に特定因子を導入することにより樹立される、ES細胞に類似した多能性幹細胞。
2006年に京都大学山中伸弥教授の研究により、世界で初めてマウス体細胞を用いて樹立に成功したことが報告された。
2) 胚性幹細胞(ES細胞:embryonic stem cell)
ES細胞は受精後6、7日目の胚盤胞から細胞を取り出し、それを培養することによって作製される多能性幹細胞の一つで、体のあらゆる組織の細胞に分化することができる。しかし、作製には受精卵を破壊する必要があり、倫理的な問題がある。また、患者自身の細胞から作製することができないため、細胞移植治療に利用する際には免疫拒絶の問題が指摘されている。
3) 継代培養
培養した細胞を培養皿から取り出し、新しい培養皿に移し、再び培養すること。
4) リプログラミング(初期化)
分化した体細胞の核がリセットされ受精卵のような発生初期の細胞核の状態に戻り、多能性幹細胞などに変化すること。
5) フィーダー細胞(支持細胞)
目的の細胞を培養する際、培養条件を整える補助的な役割をもつ細胞。通常、薬剤や放射線処理によって分裂できないように処理されている。iPS細胞の培養の際には、薬剤や放射線で不活化されたマウス胎仔由来の線維芽細胞などがフィーダー細胞として用いられている。
6) ウイルスベクター
ベクターとは、細胞外から内部へ遺伝子を導入する際の「運び屋」を指す。ウイルス由来のベクターは、遺伝子導入効率の高さから盛んに開発されてきた。目的遺伝子をウイルスに組み込み、細胞に感染させることにより遺伝子を導入する。レトロウイルスベクターは、このうちの1つであり、宿主の細胞に感染後、宿主のDNAのなかに入り込み、自らのウイルスを増殖させる性質を利用するものである。
7) コロニー
単一の培養細胞に由来する細胞群
8) テラトーマ(奇形腫)
ES細胞やiPS細胞を免疫不全マウスの皮下などに注射すると腫瘍を形成する。この腫瘍はテラトーマと呼ばれ、様々な種類の組織が混在している。テラトーマを観察し、多様な組織への分化を確認することは細胞の分化多能性を調べる一般的な方法の一つである。
広島大学病院 顎・口腔外科 山崎 佐知子(ヤマサキサチコ)
Email:sayamasaki*hiroshima-u.ac.jp
TEL:082-257-5667 FAX:082-257-5669
(*は半角@に置き換えてください。)
本研究への支援
研究経費:科学技術振興機構 研究成果最適展開支援プログラム A-STEP
課題名:ヒトiPS細胞の樹立と未分化能および多分化能を維持可能なフィーダー細胞を必要としない無血清培地の開発
研究責任者:岡本哲治

 Home
Home





