広島大学大学院理学研究科数理分子生命理学専攻 特任講師 落合 博
電話:082-424-5529
Eメール:ochiai@hiroshima-u.ac.jp
平成27年6月17日
細胞内で目的の遺伝子の位置と活性を同時に可視化する技術(ROLEXシステム)を開発!!
本研究成果のポイント
- DNAおよびRNA塩基配列特異的結合タンパク質を利用した、生細胞内における特定遺伝子の転写活性および核内配置の同時可視化技術(ROLEXシステム)の開発
- マウス胚性幹(ES)細胞において、多能性維持に重要な因子Nanog遺伝子の転写が不活性状態にある場合、核内ゲノムDNAが部分的に動きやすくなる現象を発見
概要
広島大学大学院理学研究科 落合 博 特任講師(広島大学クロマチン動態数理研究拠点メンバー)は、同研究科の菅原 武志 特任助教(広島大学クロマチン動態数理研究拠点メンバー)および山本 卓 教授(広島大学ゲノム編集研究拠点リーダー)との共同研究により、特定DNAおよびRNA塩基配列に特異的に結合するタンパク質(※1)を利用した、生細胞内における特定遺伝子の転写活性および核内配置の同時可視化技術の開発に成功しました。
また本技術を利用して、マウス胚性幹(ES)細胞において、多能性維持に重要な因子Nanog遺伝子の転写が不活性状態にある場合、核内ゲノムDNAが部分的に動きやすくなる現象を発見しました。本技術は他の細胞種への応用も可能であり、高次なゲノムDNA構造が関与する複雑な遺伝子発現制御機構の理解などの基礎生命科学研究だけでなく、再生医療などの応用研究への発展に貢献することが期待されています。
本研究成果は、英国の科学雑誌『Nucleic Acids Research』6月18日付けオンライン版に掲載されます。
URL:http://nar.oxfordjournals.org
DOI:10.1093/nar/gkv624
論文タイトル: " Simultaneous live imaging of the transcription and nuclear position of specific genes."
著者:落合 博1, 菅原 武志1, 山本 卓1,2
1 広島大学 クロマチン動態数理研究拠点
2 広島大学大学院理学研究科数理分子生命理学専攻
背景
ゲノムDNAは高次に折り畳まれて細胞核内に格納されています。近年の技術革新(3C関連技術[※2]や高解像顕微鏡によるFISH解析[※3])により、特定遺伝子の発現と高次ゲノムDNA構造に相関があることが見出されてきました。しかし、既存技術ではゲノムDNAの核内構造と遺伝子発現を同時かつ経時的に捉えることができませんでした。
上記のような複雑な遺伝子発現制御機構の包括的な理解には、時間情報を含んだ高次元の情報取得が必須であり、特定遺伝子の転写活性と核内動態を経時的に解析する技術が望まれていました。
研究手法と成果
近年、CRISPR/Casシステムが生命科学分野でゲノム編集ツールとして広く利用されてきていますが、今回我々は本システムを特定DNA領域の可視化に応用しました。また、転写をライブイメージングするためにMS2システムを利用しました。
本研究において我々は上記2つの技術を組合せることにより、特定遺伝子の転写と核内配置を同時に可視化できることを示しました(図1)。本研究では、さまざまな手法で詳細に解析することにより、本システムの特異性および標的遺伝子発現量に影響がないことを示し、“Real-time Observation of Localization and EXpression (ROLEX)” システムと名付けました。
また本技術を利用して、マウスES細胞において、多能性維持に重要な転写因子をコードする遺伝子Nanogの転写活性依存的に核内ゲノムDNAの流動性が局所的に変化する現象を見出しました(図2)。
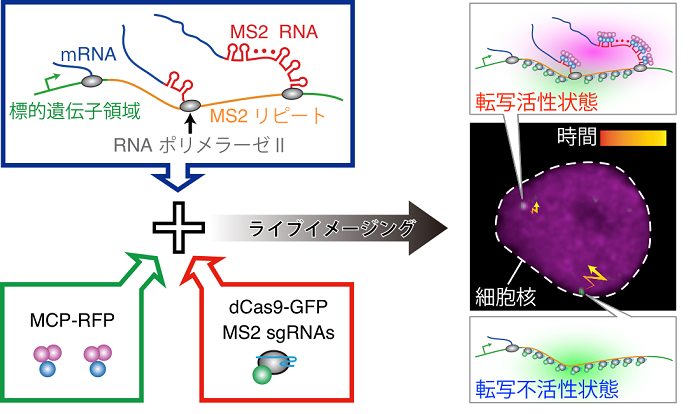
図1 ROLEXシステムの模式図。
特定遺伝子の核内配置は緑色蛍光スポットから、転写活性はマゼンタ蛍光スポットから判断できる。
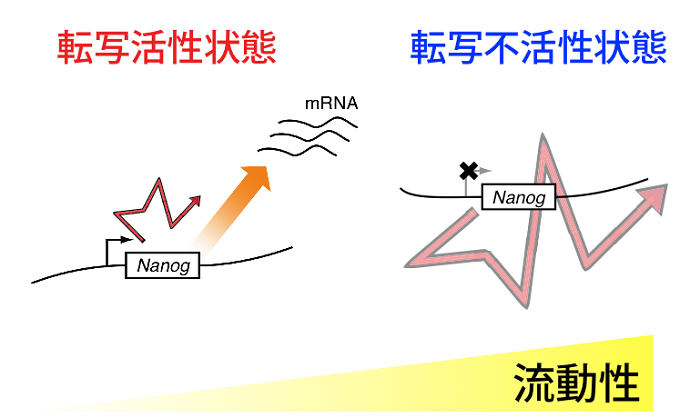
図2 転写活性状態依存的な核内遺伝子領域の流動性変化の模式図。
多能性維持に重要な遺伝子NanogはマウスES細胞において転写活性が低い場合に高い流動性を示すことがわかった。
期待される波及効果と今後の展開
ゲノムDNA構造は細胞ごとに異なっていることが知られていますが、それがどの程度細胞の性質差に関与しているかは明らかになっていません。本技術によって、高次に折り畳まれたゲノムDNA構造の動的変化に伴う遺伝子発現変化の解明とともに、個々の細胞ごとのゲノムDNA構造の違いがどのように細胞ごとの性質差の出現に関与しているかを明らかにできることが期待できます。
細胞ごとの性質差はがん細胞の抗がん剤への耐性や、多能性幹細胞から特定細胞種への均質な分化誘導の阻害などに関与していると考えられています。そのため本研究成果は、細胞ごとの性質差の出現原因の解明に繋がることが期待され、基礎生命科学研究だけでなく、再生医療やがん治療などの応用研究への発展に貢献することが期待されます。
本研究は、文部科学省生命動態システム科学推進事業「核内クロマチン・ライブダイナミクスの数理研究拠点」およびJSPS科研費 25830138, 15K18467の助成を受けたものです。
用語説明
※1 DNAおよびRNA塩基配列に特異的に結合するタンパク質
DNA塩基配列に特異的に結合するタンパク質とは、緑色蛍光タンパク質と標的配列に結合するガイドRNAを認識してDNAに結合するタンパク質(Clustered Regularly Interspaced Short Palindromic Repeats/ CRISPR associated protein without nuclease activity, CRISPR/dCas9)を融合させた人工タンパク質である。一方、RNA塩基配列に特異的に結合するタンパク質とは、赤色蛍光タンパク質とMS2コートタンパク質を融合させた人工タンパク質である。標的遺伝子領域に特定のDNA塩基配列(MS2リピート)を導入することにより、その遺伝子の転写と核内配置を同時に可視化できる。
※2 3C関連技術
Chromosome conformation capture (3C)法及びその派生技術。本技術により特定DNA領域間の物理的接触頻度を見積もることが可能で、さまざまな細胞種において高次ゲノムDNA構造が明らかにされてきた。 しかし、得られるデータは複数細胞における平均値であり、個々の細胞の性質差を考慮できないことが欠点である。
※3 FISH解析
Fluorescence in situ hybridization (FISH)。蛍光標識したDNAプローブを利用して、特定のゲノムDNA領域や特定遺伝子の転写を可視化する手法である。近年の蛍光顕微鏡技術の発展により、核内ゲノムDNA構造と遺伝子発現の関係を詳細に解析できるようになってきた。細胞を固定する必要があるため、経時変化をみることができないことが欠点である。
広島大学学術・社会産学連携室広報グループ 楠本 記章
TEL:082-424-6762 FAX:082-424-6040
E-mail:koho@office.hiroshima-u.ac.jp
(@は半角に直して送信して下さい。)

 Home
Home





