大学院医歯薬保健学研究院基礎生命科学部門
医学分野 ウイルス学
教授 坂口剛正
Tel:082-257-5157 FAX:082-257-5159
E-mail:tsaka*hiroshima-u.ac.jp
(注:*は半角@に置き換えてください)
平成27年9月30日
ウイルスが、増殖を抑制するはたらきを持つインターフェロンから逃れるメカニズムを解明
~ヒトパラインフルエンザウイルスなどの治療薬開発が可能に~
本研究成果のポイント
- ウイルスがインターフェロン(*1)の作用に対抗するメカニズムを解明。
- ウイルスのC蛋白質(*2)が、転写因子STAT1(*3)に結合して、インターフェロンが活性化するための構造変換を抑えていたことを解明。
- C蛋白質をもつヒトパラインフルエンザウイルス(*4)の治療薬の開発が可能になった。
概要
広島大学大学院医歯薬保健学研究院の小田康祐助教、坂口剛正教授、的場康幸准教授、杉山政則教授らの研究グループは、ウイルスの増殖を抑制するはたらきを持つインターフェロンの発現に必要な転写因子STAT1と、インターフェロンの作用を止めるウイルスのC蛋白質が結合してできる複合体の蛋白質結晶構造を、センダイウイルス(*5)を用いて明らかにしました。
ヒトはウイルスに感染するとインターフェロンを分泌して、ウイルスの増殖を抑制するため、インターフェロンはウイルスに対する強力な武器となります。一方で、ウイルスはインターフェロンの作用から逃れるように進化してきています。センダイウイルスは、ウイルスのC蛋白質がインターフェロンの作用発現に必須である転写因子STAT1に結合して、インターフェロンの作用を止めることが知られています。
今回、この結合複合体の構造を原子レベルで明らかにしたことで、これを阻害する薬剤の開発が可能になりました。これにより、センダイウイルスと近縁で、C蛋白質をもつヒトパラインフルエンザウイルス(小児気管支炎、肺炎、クループ症候群をおこす)の治療薬の開発が可能になりました。また、同様の戦略で他のウイルスに対する薬剤の開発も期待できます。
論文:Structural basis of the inhibition of STAT1 activity by Sendai virus C protein,
著者:Oda K, Matoba Y, Irie T, Kawabata R, Fukushi M, Sugiyama M, Sakaguchi T.*
*Corresponding Author
掲載雑誌:Journal of Virology, 2015,
DOI: 10.1128/JVI.01887-15
雑誌発行日:平成27年11月15日
※現在、以下のURLで論文の原稿(校正前)が公開されています。
http://jvi.asm.org/content/early/2015/08/28/JVI.01887-15.abstract
背景
ウイルス感染症は、最近だけでも、ノロウイルス、H7N9インフルエンザウイルス、エボラウイルス、MERSコロナウイルスと大きな社会問題となっています。一方、小児科でみられる気管支炎、肺炎といった呼吸器感染症も多くはウイルスによるものです。原因ウイルスは、インフルエンザウイルス、RSウイルス、ヒトメタニューモウイルスとともに、ヒトパラインフルエンザウイルス1〜4型です。ヒトパラインフルエンザウイルスはセンダイウイルスに近いウイルスで、多くがC蛋白質をもっており、これによって宿主のインターフェロンの作用から逃れていることが知られています。この分子機構を明らかにすることは、ウイルスがインターフェロンに対抗するための仕組みを理解することとともに、この過程を阻害することでヒトパラインフルエンザウイルスの治療を行う道を開くことにつながります。
研究成果の内容
C蛋白質による阻害機構を解明するために、C蛋白質(の一部)と転写因子STAT1のN末端ドメインを、それぞれ大腸菌で大量生産して精製し、両者を合わせてできる複合体を結晶化して、Spring-8(大型放射光施設、兵庫県)での実験を経て蛋白質立体構造を決定しました。これによって両者の相互作用が原子レベルの高い解像度で解明されました。さらにC蛋白質がSTAT1に結合することによって、STAT1二量体の構造を固定することが明らかになりました。
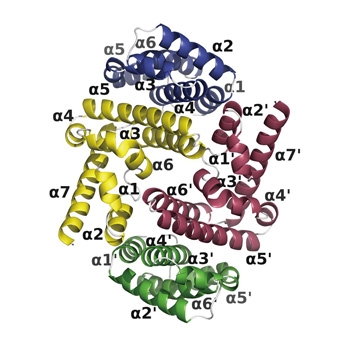
図1:C蛋白質(C末端側半分)とSTAT1末端ドメインの結合体蛋白質結晶構造(STAT1二量体に対して、C蛋白質は2分子結合する)
STAT1は水溶液中では二量体を形成しており、インターフェロン-γのシグナル伝達の際にも、細胞質で同様に二量体をとります。STAT1はN末端ドメインと、その他のコアフラグメントが自由に回転するので、二量体全体は、いくつかの異なる構造をとり得ます。C蛋白質がSTAT1に結合すると、二量体をパラレル型で、かつ活性化できない形に固定して、さらにその結合体の高分子複合体を形成することで、STAT1の活性化を防いでいることが明らかになりました。
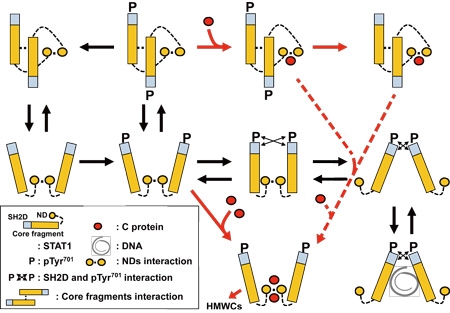
図2:C蛋白質の結合による、STAT1二量体の構造変化
このことによって、STAT1とC蛋白質の結合を阻害する低分子阻害薬をデザインして作製することが可能になりました。この阻害薬により、インターフェロンの作用により、ウイルス増殖を抑制でき、さらには新たな抗パラインフルエンザウイルス薬を作ることができます。
今後の展開
研究面では、インターフェロン-α/βのシグナル伝達を担うSTAT1とSTAT2のヘテロ二量体を、C蛋白質がどのようにして阻害するかを解明する必要があります。これによってC蛋白質によるインターフェロン作用阻害メカニズムが完全に明らかになると期待されます。
また前述のように、STAT1とC蛋白質の結合を阻止する低分子薬剤の開発によって、ヒトパラインフルエンザウイルスの治療薬を作ることができます。現在、入手できる化合物ライブラリーを用いて、スクリーニングを開始しています。このような戦略は他のウイルスでも可能です。例えば、インフルエンザウイルスでは、NS1が抗インターフェロン作用をもつ蛋白質であり、NS1の作用をとめる薬剤は抗インフルエンザウイルス薬になり得ます。将来は、同様に薬剤を開発することを試みます。
参考資料
(*1)インターフェロン
ウイルスならびに腫瘍に対抗するサイトカイン。身体へのウイルスの侵入によって分泌される。現在は人工的に調製してC型肝炎の治療などに用いられている。
(*2)C蛋白質
一部のパラミクソウイルスがもつ蛋白質であり、インターフェロンに対抗するなどしてウイルスの増殖を増強するアクセサリー蛋白質。
(*3)STAT1(Signal Transducers and Activators of Transcription 1)
細胞表面のインターフェロン受容体にインターフェロンが結合すると、細胞質のSTAT1がリン酸化され、核内に入って染色体DNAに結合して、抗ウイルス状態誘導などに必要な蛋白質を合成する転写を活性化する。インターフェロン-α/βではSTAT1/STAT2ヘテロ二量体として働き、インターフェロン-γではSTAT1ホモ二量体として働く。
(*4)ヒトパラインフルエンザウイルス
パラミクソウイルス科レスピロウイルス属。1〜4型があり、小児気管支炎、肺炎、クループ症候群を起こす。
(*5)センダイウイルス
マウス肺炎ウイルス。ヒトパラインフルエンザウイルス1型と抗原が交叉するほど近縁である。

 Home
Home





