広島大学大学院医歯薬保健学研究院基礎生命科学部門分子病理学
教授 安井 弥(やすい わたる)
TEL:082-257-5145
E-mail:wyasui*hiroshima-u.ac.jp(*は半角@に置き換えてください)
平成27年12月9日
記 者 説 明 会(12月10日11時・広島)の ご 案 内
胃がん、前立腺がんの発生・増殖にかかわる転写超保存領域の同定と発現制御メカニズムを発見
~発がんの新たな機序の解明とがん診療への応用の可能性~
本研究成果のポイント
- 胃がん、前立腺がんにおいて、特定の転写超保存領域(T-UCR(*1))の発現異常を発見。
- T-UCRはDNAメチル化(*2)の影響、あるいはマイクロRNA(*3)との相互作用により、がんの発生や増殖に関わっている。
- がんにおける非翻訳RNA(*4)の複雑なネットワークが解明され、全く新しいがんの診断、治療法の開発が期待される。
概要
広島大学大学院医歯薬保健学研究院基礎生命科学部門の安井 弥教授、本学大学院医歯薬学総合研究科博士課程の後藤景介さんらによる研究グループは、胃がん、前立腺がんにおいて、特定の転写超保存領域(T-UCR)の発現異常が生じていることを突き止め、発現制御メカニズムとがんにおける機能を明らかにしました。この発見は、日本国内において罹患率の高い胃がん、近年増加が著しい前立腺がんの診断治療へ、新たな方向性をもたらしうると期待されます。
本研究成果は、平成27年12月7日(英国時間)、英国科学誌「Oncogene」(オンライン版)に掲載されました。
発表論文
著 者
Keisuke Goto, Sho Ishikawa, Ririno Honma, Keiji Tanimoto, Naoya Sakamoto, Kazuhiro Sentani, Naohide Oue, Jun Teishima, Akio Matsubara, Wataru Yasui∗
* Corresponding Author(責任著者)
論文タイトル
The transcribed-ultraconserved regions in prostate and gastric cancer:DNA hypermethylation and microRNA-associated regulation
掲載誌
Oncogene
URL
http://www.nature.com/onc/journal/vaop/ncurrent/index.html
本研究成果につきまして、下記のとおり、記者説明会を開催しご説明いたします。
ご多忙とは存じますが、是非ご参加いただきたく、ご案内申し上げます。
記
日時: 平成27年12月10日(木) 11:00~12:00
場所: 広島大学霞キャンパス 広仁会館1階中会議室
出席者:
広島大学大学院医歯薬保健学研究院 教授 安井 弥
広島大学大学院医歯薬学総合研究科博士課程 後藤 景介
広島大学学術・社会産学連携室広報グループ
島原 洋(しまはら ひろし)
TEL:082-424-4657
E-mail:koho*office.hiroshima-u.ac.jp(*は半角@に置き換えてください)
研究の背景
T-UCRはヒト、マウス、ラットなど生物種をこえて100%同一の配列が保存されているという特徴を持つ非翻訳RNAです。生物種間で保存されているということから、生物の発生や分化との関連が指摘されています。
近年の研究から、いくつかのT-UCRはがんにおいて発現が変化していることが報告されています。しかし、がんにおけるT-UCRの発現異常が具体的にどのようなメカニズムによりもたらされているか、またT-UCRががんにおいてどのような働きを担っているのかは、ほとんど分かっていませんでした。
研究成果の内容
研究グループは、定量的RT-PCR法を用いて胃がん、前立腺がんにおいて発現異常を示すT-UCRを同定し、がんにおいて特徴的に発現が低下していたUc.158+Aと発現が上昇していたUc.416+Aという2つのT-UCRに着目し、発現異常をもたらすメカニズムとがんにおける役割について解析しました。
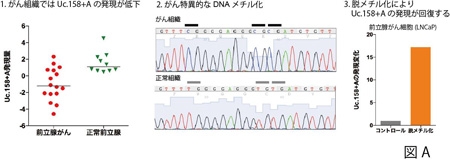
Uc.158+Aの配列を詳細に調べ、がん細胞(組織)では過剰なDNAメチル化を受けており、実験的にメチル化を抑える(脱メチル化)と発現を回復させられること、メチル化を加えると発現が抑制されることも確認され、Uc.158+AはがんにおいてDNAメチル化の影響を受け、発現が抑制されることを明らかにしました(図A)。
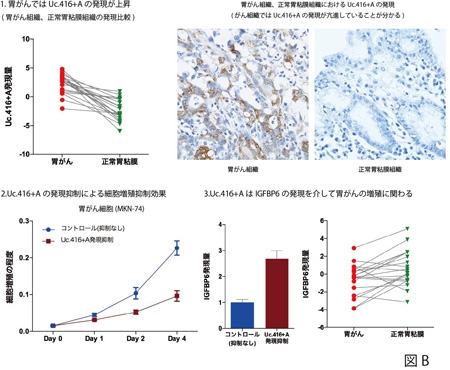
一方、がんにおいて特徴的に発現が上昇しているT-UCRは、新たながん診断のマーカー、治療のターゲットになる可能性があります。そこで、がんで発現が上昇していたUc.416+Aのオンラインデータベースを用いT-UCRとマイクロRNAとの関連についてシミュレーションを行い、Uc.416+AとmiR-153というマイクロRNAに関連があると仮定しました。胃がん細胞株を用いたインビトロの実験で、miR-153の発現を調節するとUc.416+Aの発現が変化することを確認しました。
さらに、Uc.416+Aの発現を抑制させることでがん細胞の増殖が抑制され、Uc.416+Aががん促進的機能をもつことが明らかになり、その増殖制御には、IGFBP6(*5)が関与していることを突き止めました。臨床検体(胃がん組織と正常胃粘膜組織)を用いた定量的RT-PCR解析において、Uc.416+Aの発現は胃がんにおいて有意に上昇していることが確認され、miR-153の発現とは逆相関関係にあることも分かりました(図B)。
今後の展開
研究チームは、胃がん、前立腺がんにおいてT-UCRの発現異常をきたすメカニズムとがんにおける役割を明らかにしました。これにより、Uc.416+Aを標的とすることでがんの増殖を抑制させる治療への応用が期待されます。さらに、現在進行中の研究では、血液中に含まれる微量のT-UCRも検出できるようになっています。患者さんにとって痛みを伴わない方法で、がんを発見し最適な治療方針を選択する上で、T-UCRは有用な指標となる可能性があります。
用語の解説
(*1) 転写超保存領域(T-UCR)
Transcribed-ultraconserved region。タンパク質に翻訳されることのない非翻訳RNAのうち、生物種をこえて100%同一の配列が保存されている領域。
(*2) DNAメチル化
DNAを構成する塩基のひとつであるシトシンにメチル基が付加する化学反応。がん抑制遺伝子の転写を強く抑制し、がんの発生に深く関わっている。
(*3) マイクロRNA
非翻訳RNAの一種で、配列の短い(22-24塩基長)の短鎖RNA。標的とする遺伝子と結合することで転写を抑制、がんをはじめとする種々の病気と関わっている。
(*4) 非翻訳RNA
一般に遺伝子は転写、翻訳を経てタンパク質として生体内で作用するが、このような遺伝子は全体の約2%しかない。残りの98%はタンパク質へと翻訳されることのない非翻訳RNAである。近年、本研究を含め、生体内における非翻訳RNAのはたらきについての研究が注目を集めている。
(*5) IGFBP6
Insulin-like growth factor binding protein=インスリン様成長因子結合蛋白。成長因子として細胞増殖や組織の発生を促すはたらきを持つIGFと結合するタンパク質。6種類のIGF結合タンパク質(IGFBP1-6)が知られており、IGFの作用を調節する機能を持つ。細胞増殖に関しては抑制的に作用すると言われている。

 Home
Home





