平成21年9月28日
生体膜内に蛋白質が薬物を輸送する仕組みを解明
-新たな診断法や治療法の開発、複雑な生命現象の解明への応用が期待-
ポイント
- 蛋白質の詳細な溶液構造を、生理的条件下で明らかにできる手法を開発
- 血中における蛋白質の薬物輸送システムを解明
- これまで未解決であった蛋白質が関わる複雑な生命現象の解明に期待
概要
現在、蛋白質の*1立体構造には、結晶化させた蛋白質をX線で解析する「X線結晶学」から得られる結晶構造が広く利用されています。
このたび、広島大学の放射光科学研究センター・松尾光一特別研究員、同・生天目博文教授、大学院理学研究科・谷口雅樹教授、同・月向邦彦特任教授からなる研究チームは、放射光*2を使用した最先端の円二色性*3測定技術(図1)とバオインフォマティックス*4による最新の計算技術を融合させ、蛋白質を結晶化させることなく、生理的条件下(蛋白質が実際に機能する環境下)である “生”の状態で、蛋白質の詳細な溶液構造を明らかにできる手法を開発しました。この方法を用い、生体膜と結合した蛋白質が、生体膜内に薬物を輸送する際の蛋白質の構造変化を、世界で初めて、詳細に解析することに成功しました。
この結果は、血中における蛋白質の薬物輸送システムの解明や改変酵素*5による薬物輸送の制御が可能となることを示しており、新規診断法や治療法の開発への応用が期待できます。また、体内での情報伝達機構、DNA複製の制御やウィルス感染の抑制機構等、これまでの手法では解析できなかった蛋白質が関わる複雑な生命現象の追跡に利用することができます。
なお、本研究成果は、平成21年9月29日(火)発行の米科学誌「Biochemistry」に掲載されます。 ※オンライン版には掲載中(掲載日:8月24日)
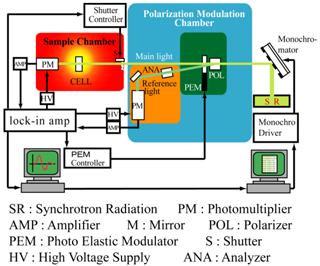
図1 広島大学放射光科学研究センターに設置された真空紫外円二色性分散計の模式図(上)と写真(下)
放射光(SR)は、直線偏光子(POL)で直線偏光に、光弾性素子(PEM)で円偏光に変調され、生体試料が保持された容器(CELL)を通過し、生体試料の円二色性シグナルは、検出器(PM)で検出される。本装置では、POLから得られるもう一つの放射光を、ロックインアンプ(lock-in amp)の参照シグナルに利用することで、円二色性データを安定化させると共に、円偏光度のモニターとして利用し、PEMの駆動電圧を自動調整させている。このような方式を光サーボリファレンスシステムといい、円二色性装置では世界で初めて導入され、高精度の円二色性測定を実現させている。
背景
蛋白質の構造は、その生物学的機能を理解する上で重要であるため、X線結晶学や核磁気共鳴法(NMR)といった原子レベルでの構造解析法が広く利用されています。しかし、これらの方法は、結晶中といった特殊な条件下や、比較的小さな蛋白質にしか適用できないため、構造解析が困難な蛋白質も多数存在します。一方、蛋白質のキラリティー*6を利用した円二色性分光法は、蛋白質の状態に制限が無く、様々な溶媒条件下で測定できるため、蛋白質が実際に機能する環境下で構造解析が可能です。また、最近では、放射光を用いることで、円二色性分光から得られる蛋白質の構造情報を格段に増加させ、最新のバオインフォマティックス技術と組み合わせて立体構造を予測する計算手法が開発されています。
この新しい円二色性分光法を利用し、同研究チームは、これまで未踏領域であった蛋白質が関わる生命現象の一つ“薬物輸送システム”の解明に向けた研究に取り組みました。
研究手法と成果
今回、研究チームは、広島大学放射光科学研究センターHiSORの真空紫外円二色性分光装置を使用し、薬物輸送に関わるα1酸性糖蛋白質のアミノ酸配列レベルでの二次構造*7を、生体膜と結合していない状態(天然状態)と結合した状態で解析しました。その結果、天然状態ではシート構造からなる立体構造を形成していましたが、生体膜と結合した状態では、へリックス構造へと大きく変化し、へリックス構造の一部が生体膜と強く相互作用していることが分かりました。また、薬物結合部位の構造は、生体膜との結合によって完全に崩壊しており、薬物は蛋白質から解放され、細胞内へと輸送される機構が明らかとなりました(図2)。
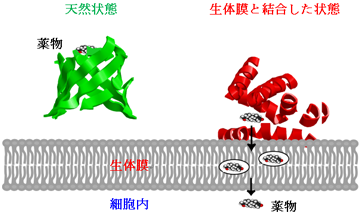
図2 生体膜を介した蛋白質の薬物輸送機構
α1酸性糖蛋白質の天然状態は、11本のβ-strandから成るβバレル構造を形成し、薬物と結合することができる。しかし、蛋白質が生体膜に近づくと正に帯電した蛋白質の一部が負に帯電した生体膜表面と相互作用すると同時に、7本のα-helixから成る構造へと急激に変化する。蛋白質の薬物結合部位のほとんどがα-helix構造に変化するため、薬物は蛋白質から放出され、生体膜を介して細胞内へと輸送される。
研究成果の意義
水溶液中の“生”の状態で、生体膜と結合した蛋白質の溶液構造が円二色性分光により明確になったことから、血中における薬物輸送機構の解明に応用することができます。また、α1酸性糖蛋白質の改変により薬物輸送を制御(促進・抑制)することが可能となり、新規診断法や治療法の開発に応用されると期待されます。さらに、薬物輸送システムだけでなく、蛋白質が関わる生体内情報伝達機構やDNA複製の制御はもとより、将来は、ウィルス感染の抑制等、これまで未解決であった複雑な生命現象の解明に応用できます。
お問い合わせ先
国立大学法人広島大学放射光科学研究センター
特別研究員 松尾 光一(まつお こういち)
TEL:082-424-6293 (事務)、082-424-6297 ext.312(直通)、FAX:082-424-6294
E-mail:pika@hiroshima-u.ac.jp
国立大学法人広島大学大学院理学研究科
特任教授 月向邦彦(げっこう くにひこ)
TEL:082-424-6481 (直通)
FAX:082-424-7327
E-mail:gekko@hiroshima-u.ac.jp
(@は半角@に置き換えた上、送信してください。)
用語解説
*1 蛋白質
生体の主要構成成分で、20種類のL型アミノ酸がペプチド結合によって連結した一本鎖ポリペプチド。アミノ酸の並び方やその長さに依存して、形成される立体構造が異なる。
*2 放射光
光速で直進する電子の進行方向が磁石などによって変えられた際に発生する電磁波。真空紫外領域からX線にわたる強力な光源であり、固体物理や生体分子構造解析等の物理・生物・化学・電子工業分野で広く利用されている。
*3 円二色性
左円偏光と右円偏光の吸収で差が生じる現象で、キラリティー*6分子の構造を敏感に反映するため生体分子の構造解析に非常に有力である。
*4 バイオインフォマティクス
応用数学、情報学、統計学等の計算科学を利用することで生物学の基本法則または生命システムの網羅的解析を試みる研究分野。特に、蛋白質の二次構造や立体構造の予測、蛋白質-蛋白質相互作用の予測、進化のモデリングなどに利用されている。
*5 改変酵素
蛋白質(酵素)を構成する特定のアミノ酸を遺伝子工学的に他のアミノ酸に改変したもの。この改変により、蛋白質の機能や構造に大きな影響を持つアミノ酸部位を知ることができ、新機能蛋白質の創製が可能となる。
*6 キラリティー
3次元の図形や物体が、その鏡像と重ね合わすことができない性質。例えば、蛋白質を構成するアミノ酸には、D型とL型の二種類があるが、両構造は重ね合わせることができないため、キラリティーを持つという。また、人の両手もキラリティーを持つ。
鏡
L型アミノ酸 D型アミノ酸
例としてアラニンを示す。
赤色:酸素原子、緑色:炭素原子、青色:窒素原子
シート構造 シート構造
*7 二次構造
蛋白質のペプチド結合間の水素結合によって形成される比較的狭い範囲にみられる規則的構造。主に、バネに似た右巻らせん構造を示すへリックス構造と全体として平面構造をとるシート構造がある。

 Home
Home