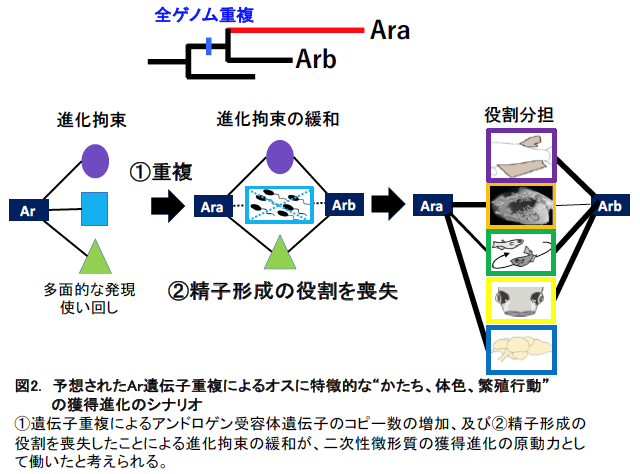
オスに特徴的な求愛行動、装飾的なかたち、派手な婚姻色の獲得進化は、多彩な繁殖戦略を可能とし、真骨魚類の爆発的な種分化と繁栄をもたらした重要な要因と考えられます。この進化には、約3億年前に真骨魚類の共通祖先で起きた全ゲノム重複が大きく貢献したことが予想されています。全ゲノム重複は、真骨魚類の美しさや多様化にどのような影響を与えたのでしょうか? 重複した遺伝子の新たな役割の獲得や役割分担の道筋には謎が多く残されています。
九州大学大学院農学研究院 国際農業教育・研究推進センター、農学研究院水族分子発生学研究室の荻野由紀子准教授を中心とする、京都大学 安齋賢特定准教授、基礎生物学研究所 渡辺英治准教授、亀井保博RMC教授、成瀬清特任教授、福井県立大学 八杉公基准教授、岡山大学理学部附属牛窓臨海実験所 片山侑駿助教(研究当時)、坂本浩隆准教授、広島大学 荻野肇教授、東京理科大学 宮川信一准教授、横浜市立大学 佐藤友美教授、井口泰泉特任教授らの研究グループは、真骨魚類(注1)の系統で特異的に起きた全ゲノム重複(注2)により、男性ホルモン(アンドロゲン)の作用を遺伝子発現に変換するアンドロゲン受容体遺伝子のコピー数が2つに増えたことに着目し、メダカ(図1)における2つの遺伝子コピーの役割について変異体を用いて詳しく比較しました。その結果、アンドロゲン受容体遺伝子が精子形成の役割を別の遺伝子に任せて、オスに特徴的な“かたち、体色、繁殖行動”に役割分担を進めて特殊化していったことを世界で初めて明らかにしました(図2)。
アンドロゲン受容体遺伝子を1コピーしか持たない哺乳類などの動物では、脳や外生殖器の性分化、精巣機能の維持、精子形成など多岐にわたる役割が1つの遺伝子で担われています。このような場合、ある役割にとって有利な変化が、他の役割には必ずしも有利とならないため、遺伝子機能の変化は強く抑制されている(保存的である)と考えられます。真骨魚類ではコピー数が増えたことに加え、精子形成の役割を喪失したことがアンドロゲン受容体遺伝子にのしかかっていた進化の抑制を緩和し、アンドロゲン受容体の役割の急速な多様化を促した可能性が示唆されます。
これまで、重複した遺伝子群は、祖先的な役割を保ちながら、役割を新たに獲得、あるいは分担することにより、より複雑な仕組みを作り上げると理解されてきました。今回の発見により、祖先遺伝子が体の中で担っていた役割を大胆に捨てて、かつコピー数を増やして仕事の分担を進めて特殊化していったことにより、真骨魚類の多様化と繁栄をもたらした美しく長いヒレや華麗な交尾ダンスが獲得されたと考えられます。魚の美しさや行動の多様化と全ゲノム重複による性ホルモン受容体遺伝子の重複進化との関連性を詳細に示した最初の例であり、生物の性的特徴の多様化とゲノム進化の関係を探る上で大きな一歩となる研究です。
本研究成果は2023年3月14日にNature Communications誌(Nature Publishing Group、イギリス)にオンライン公開されました。
メダカやグッピーなど多くの真骨魚類は、ヒレの伸長や交接器への変化、婚姻色、繁殖行動などに多種多様な性的特徴を示します。その多くは性成熟に伴い精巣から分泌された男性ホルモン(アンドロゲン)の影響によりあらわれることが知られています。かたちや求愛行動の性差の獲得は多様な繁殖戦略を可能とし、真骨魚類の繁栄を支えた要因と考えられますが、その進化の道筋には謎が多く残されています。
真骨魚類の進化の過程では、脊椎動物の共通祖先で起きた2回の全ゲノム重複に加え、真骨魚類の系統だけで約3億年前に3回目の全ゲノム重複が起きたことが知られています。これにより余剰な遺伝子が生まれて、その働きそのものや体の中で働くタイミングや場所が変化した結果、さまざまな進化が促進されたと予想されています。しかし、真骨魚類系統における性的特徴の急速な多様化と全ゲノム重複の間にどのような関係があるのか、その詳細は明らかにされていませんでした。
この謎を解くため、アンドロゲンの作用を遺伝子発現の変化に変換するアンドロゲン受容体(Ar)遺伝子に注目しました。この遺伝子を1コピーしかもたない哺乳類では、脳神経系や内外生殖器などにArが多面的な役割を果たすことから、何らかの変化が生じると体の様々な部分に影響を及ぼします。そのため、遺伝的な変化が起こりにくい状態にあると考えられます。一方で、真骨魚類では、ゲノム重複によりアンドロゲン受容体遺伝子が2コピーのオオノログ(注3、Ara、Arb)に増えたため、進化的な拘束から解放され、重要な役割については重複遺伝子の補償作用から冗長性を確保しつつ、新たな役割を獲得したであろうことが予想されました。実際、荻野らのこれまでの研究(参考文献1、2)からAraはArbよりも進化速度が早く、より高い転写活性化能、アンドロゲンのない状態でも核移行するなど、ユニークな性質を獲得したことが見出されています。
本研究では、メダカ(図1)の2コピーのArオオノログ(Ara、Arb)の役割を詳しく比較するため、それぞれの遺伝子の機能を喪失したメダカ変異体を用い、オスの表現型を外部形態、精子形成、繁殖行動に至るまで網羅的に解析しました。
まず、Ara・Arb両方の遺伝子を破壊されたオス(ar DKO)、Ara、 Arbそれぞれの遺伝子を破壊されたオス (ara KO、arb KO)を用いて、野生型メスと繁殖できるのかを調べました。ar DKOは求愛円舞行動をほとんどとらず、メスとの交尾に至ることがありませんでした。一方で、ara KO、arb KOはいずれもオスに特徴的な求愛円舞行動をとることができましたが、ともにメスと交尾に至る頻度や自然産卵での受精率は野生型よりもはるかに低い結果となりました。従って、繁殖に必須の求愛円舞行動の発現は、2つのArオオノログの両方が補償的に担っているものの、高い繁殖成功には2コピーの両方が必須であることがわかりました。このことは、2コピーの間で何らかの機能的な役割分担が存在することを示唆しています。そこで、2コピーそれぞれの変異体の表現型を詳しく比較して両者の役割を調べたところ、Arbは繁殖に必要なヒレのかたちのオス化や性的モチベーションを主に制御しているのに対し、進化速度の早いAraは闘争形質である牙のような歯の発達やメスによる交尾の受け入れを促す行動要素など、異なった役割を担うように進化したことが明らかとなりました(図2)。さらに興味深いことに、アンドロゲン受容体を全く持たないar DKOでも数や運動能、受精能に問題のない精子が生産されており、メダカではArを介したアンドロゲンの作用が精子形成に必須でないことが明らかとなりました。ヒトやマウスなどの哺乳類に加え、真骨魚類の全ゲノム重複直後にメダカに至る系統と分岐したニホンウナギでは、精子形成にアンドロゲンが必須の役割を果たすことが知られています。従って、真骨魚類のArを介した精子形成の役割は、全ゲノム重複後の進化の過程で失われたと推測されます。
続いて、2つのArオオノログの役割分担の詳細な仕組みを探るために、それらの遺伝子を発現する細胞を蛍光標識により可視化し、かつ目印(タグ)をつけて受容体タンパク質の細胞の中での局在を観察できる遺伝子改変メダカを作成しました。Arbが主要な発現を果たす臀ビレの骨の分岐構造周辺では、Arbが強く発現し核に局在している一方で、Araの発現や核局在は明瞭でなく、ara KO、arb KOの表現型の違いと発現パターン及び細胞内の局在の違いには相関がみられました。さらに、Arbはオスの脳においてメス的な性行動を促進する遺伝子発現を抑制するなど、Arオオノログ間ではそれらの下流で働く遺伝子のレパートリーも大きく異なることがわかりました。従って、タンパク質のコード領域だけでなく、遺伝子発現を制御するスイッチ領域にも突然変異を蓄積して変化していった結果、Arオオノログの役割分担が生じたことが推測されます。
以上の結果から、真骨魚類ではArが2コピーに倍化したことに加え、精子形成の役割を喪失したことがAr遺伝子にかかっていた進化拘束を緩和し、オスに特徴的な“かたち、体色、繁殖行動”の進化の起爆剤として働いた可能性が考えられます。
メダカ属魚類は東アジアや東南アジアに37種以上が生息しており、ヒレの長さや婚姻色などオスに特徴的な“かたちや繁殖行動”には顕著な多様性がみられます。Arオオノログによりタンパク質が合成される遺伝子群についての種差やその調節の仕組みを種間で詳しく比較することで、かたち、体色、繁殖行動の多様化を導いた仕組みの詳細を明らかにしたいと考えています。
(注1):脊椎動物の系統の中で、ヒトやマウスに至る系統から、サメやエイなどの軟骨魚類が分岐した後に、条鰭類と呼ばれる硬骨魚類の系統が分岐した。真骨魚類はこの条鰭類の中で、多数を占めるグループであり、2万6千種以上の多数の種(脊椎動物の約半数)を含んでおり、多様な性的特徴を示す。
(注2):受精卵が核分裂の後の細胞分裂に失敗して、遺伝子のセット(ゲノム)が並ぶ染色体の数が2倍になってしまう現象。全ての遺伝情報が倍化する。脊索動物から脊椎動物が進化するにあたり2回、真骨魚類の系統では、さらに1回多く3回の全ゲノム重複が起きたとされる。それが多様な形質発現を可能にしたと考えられている。
(注3):ゲノム重複に伴う重複遺伝子。脊椎動物における全ゲノム重複を発見し、その重要性を提唱した大野 乾(すすむ)先生にちなんでオオノログと呼ばれる。
参考文献1: Ogino Y, Katoh H, Kuraku S, Yamada G. Evolutionary history and functional characterization of androgen receptor genes in jawed vertebrates. Endocrinology. 2009, 150(12):5415-27. Doi: 10.1210/en.2009-0523.
参考文献2: Ogino Y, Kuraku S, Ishibashi H, Miyakawa H, Sumiya E, Miyagawa S, Matsubara H, Yamada G, Baker ME, Iguchi T. Neofunctionalization of androgen receptor by gain-of-function mutations in teleost fish lineage. Mol Biol Evol. 2016, 33(1):228-44. Doi: 10.1093/molbev/msv218.
本研究は JSPS 科研費 (P15K07138, JP19K06741, JP20H04928, JP16H06280, JP19H03049, JP22H00386)、基礎生物学研究所共同利用研究、環境省、アステラス病態代謝研究会、内藤記念科学振興財団、九州大学「女性枠設定による教員採用・養成システム」、「女性研究者養成システム」の助成を受けたものです。

 Home
Home