放射光科学研究所
准教授 松尾 光一(まつお こういち)
Tel:082-424-6293 FAX:082-424-6294
E-mail:pika@hiroshima-u.ac.jp
大学院先進理工系科学研究科物理学プログラム
大学院生 今浦 稜太(いまうら りょうた)
Tel:082-424-6293 FAX:082-424-6294
E-mail:d220926@hiroshimia-u.ac.jp
広島大学大学院先進理工系科学研究科の今浦稜太大学院生、鳥取大学大学院工学研究科の河田康志教授、広島大学放射光科学研究所(以下「HiSOR」という)の松尾光一准教授は、放射光(注1)を利用した真空紫外円二色性分光法(注2)および直線二色性分光法(注3)による実験と、分子動力学(以下、「MD」という)シミュレーション(注 4)による理論計算を組み合わせることで、αシヌクレイン(以下、「αS」という)が、神経細胞内の小胞膜上で“アミロイド線維(凝集体)”(注5)に変化する直前に形成する分子構造を明らかにすることに成功しました。αSは、パーキンソン病(注6)を誘発する物質“アミロイド線維”を形成するたんぱく質であり、この分子構造がわかると、アミロイド線維の蓄積が原因と考えられるパーキンソン病、アルツハイマー病、筋萎縮性側索硬化症(注7)などの神経変性疾患の抑制や治療への応用が期待できます。
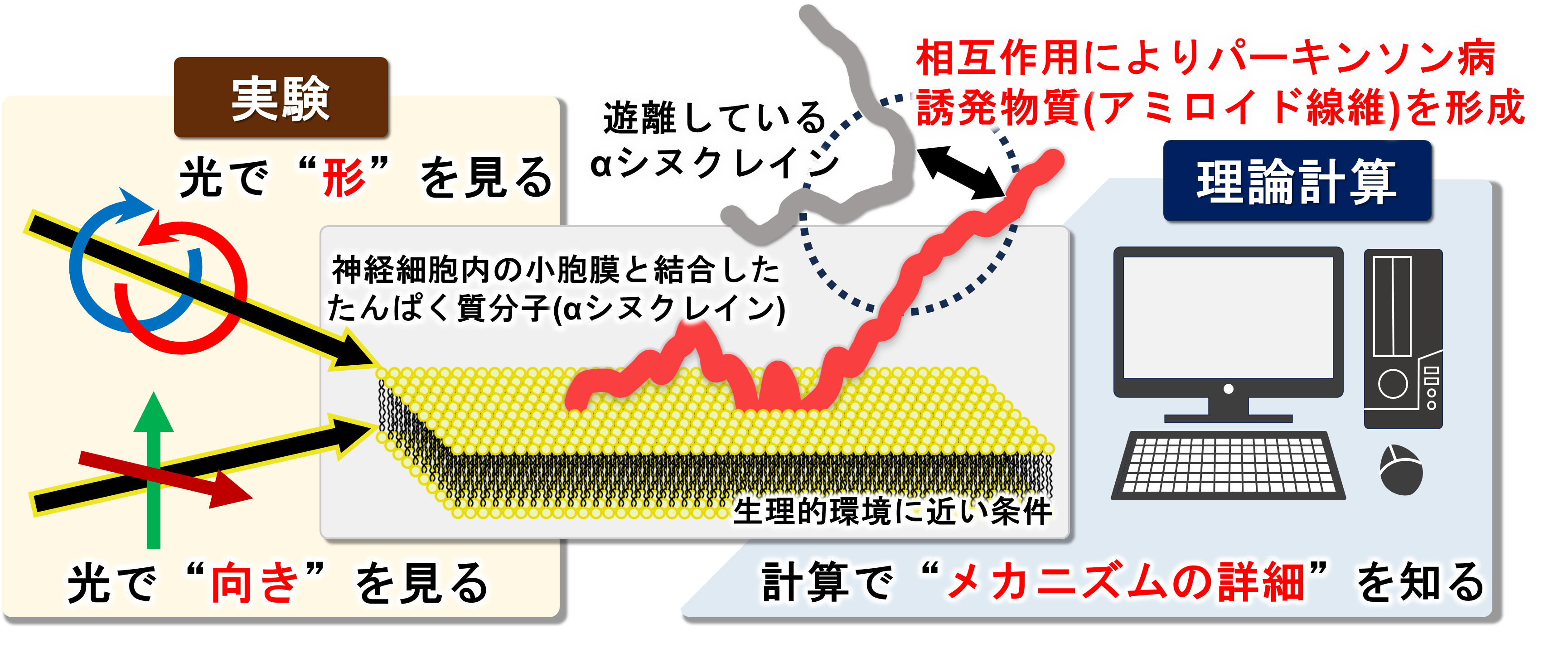
図1 神経細胞内でアミロイド線維を形成する直前のたんぱく質分子(αシヌクレイン)
本研究成果は、米国の科学誌「Langmuir」に2024年9月16日付でオンライン掲載されました。
本研究は、科学研究費助成事業(課題番号:22 K06163、23H04597)による支援を受けて実施されました。
・掲載雑誌:Langmuir
・論文タイトル:“Salt-induced hydrophobic C-terminal region of α-synuclein triggers its fibrillation under the mimic physiologic condition”
・著者:Ryota Imaura, Yasushi Kawata, Koichi Matsuo
・掲載日:2024年9月16日
・DOI: https://doi.org/10.1021/acs.langmuir.4c02178
・URL:https://pubs.acs.org/toc/langd5/40/37
近年、パーキンソン病や筋萎縮性側索硬化症といった神経変性疾患の原因解明に向けた研究が世界中で進められています。これらの疾患は、脳内に異常なたんぱく質が蓄積し、神経細胞がダメージを受けることで発症するとされています。その中でも、高齢化が進む国内において、近年急増しているパーキンソン病の原因として注目されているのが「αシヌクレイン(αS)」というたんぱく質です。
αSは、通常、脳の神経細胞内に存在し、神経伝達の調整をサポートする役割を果たしています。しかし、何らかの原因でαSが異常な形態をとり、アミロイド線維という繊維状の凝集体を形成すると、神経細胞に有害な影響を与え、神経細胞の死滅や症状の進行を引き起こし、パーキンソン病の原因となることがわかっています。よって、アミロイド線維の形成機構を解明することは、疾病メカニズムの理解や治療法を開発する上でも役立ちます。具体的には、αSが神経細胞内のシナプス小胞膜という膜に結合すると、ヘリックス構造(注8)という構造に変化します。その後、シナプス小胞膜上でαSが異常蓄積してストランド構造(注8)から成るアミロイド線維が形成されます(図2)。アミロイド線維の毒性や形成速度は、シナプス小胞膜に最初に結合したαSの構造に強く依存するため、この構造を明らかにすることが重要です。しかしシナプス小胞膜と結合したαSの構造は、非常に複雑で観測が難しく、アミロイド線維がどのように形成されるのかについては不明な点が多く存在しています。また生体内に普遍的に存在するNaClなどの塩は、アミロイド線維の形成に大きな影響を与えますが、どのようなメカニズムで寄与しているかについては未だ明らかではありません。
そこで本研究ではシナプス小胞模倣膜と塩が存在する生理的環境に近い条件下で、膜と結合したαSについて真空紫外円二色性分光測定および直線二色性分光測定を行い、得られた結果をMDシミュレーションを用いて解析することにより、αSが膜結合した構造を分子レベルで観測し、アミロイド線維形成にとって重要な領域およびその形成メカニズムを明らかにすることを試みました。
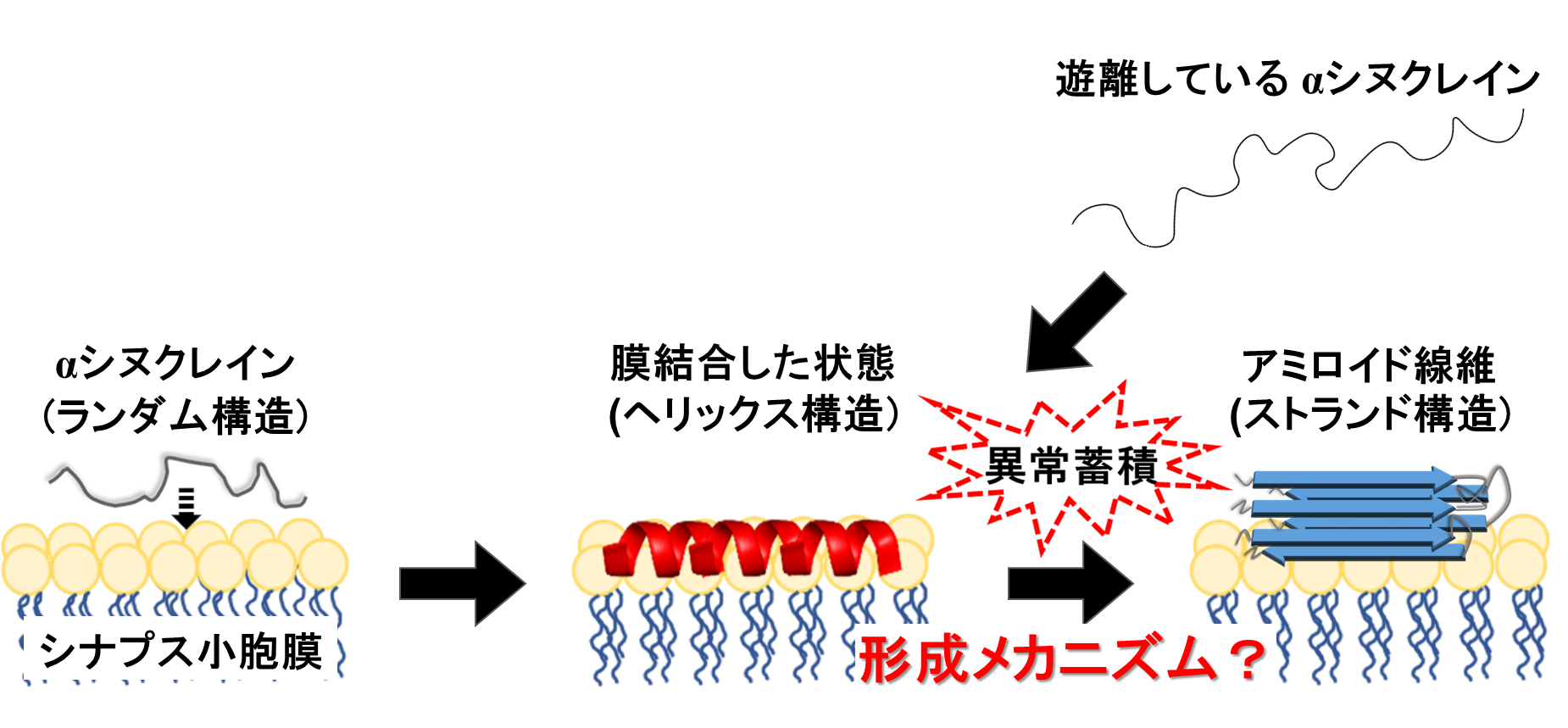
図2 これまでに提案された神経細胞内のαSが生体膜と結合した状態からアミロイド線維に構造変化する際の経路
初めに、NaCl(塩)がある時とない時で、シナプス小胞模倣膜上でのαSのアミロイド線維の形成を、ThT蛍光測定(注9)を用いて観測した結果、塩がアミロイド線維形成を促進することを確認しました(図3)。
つぎにαSの線維形成メカニズムを解明するために、HiSORに設置された真空紫外円二色性装置を用いて、NaCl(塩) がある時とない時で、シナプス小胞模倣膜と結合したαSの構造を観測しました。塩の有無にかかわらず、生体膜と結合するとαSがランダム構造(注8)からヘリックス構造(注8)に変化することが分かりました。しかし、塩がある時は、ない時と比較して、ヘリックス構造の量が減少することが分かりました(図4A)。また直線二色性測定から、ヘリックス構造とチロシン残基の膜表面との相互作用は、塩の存在により減少することが分かりました(図4B)。αS の1-60番目のアミノ酸領域および96-140番目のアミノ酸領域の膜相互作用の様子をMDシミュレーションによって個別に解析した結果、それぞれの領域が塩の有無にかかわらずヘリックス構造とランダム構造を形成することが分かりました。また、興味深いことに、ランダム構造を形成する96-140番目の領域内のチロシン残基などの水を避ける性質を持つアミノ酸残基は、塩がない時に膜相互作用に関与する一方、塩がある時には関与しないことが明らかになりました(図4C)。以上の結果から、膜相互作用が弱くランダム構造を形成する96-140番目のアミノ酸領域内で膜相互作用に関与しない水を避ける性質を持つアミノ酸残基の溶媒への露出が、塩がある時に増加し、溶媒中の遊離αSとの相互作用を促進させ、アミロイド線維形成を誘発することが明らかになりました(図5)。
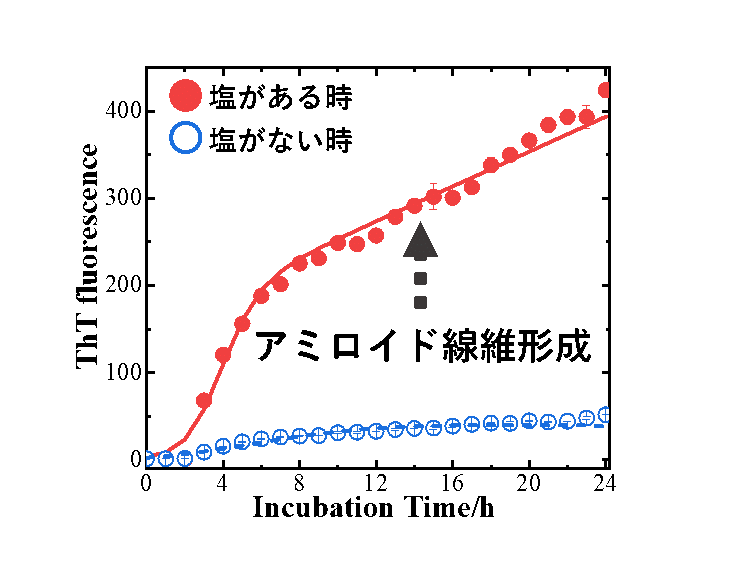
図3 ThT蛍光測定によるアミロイド線維形成の時間変化観測(青色:塩がない時、赤色:塩がある時)
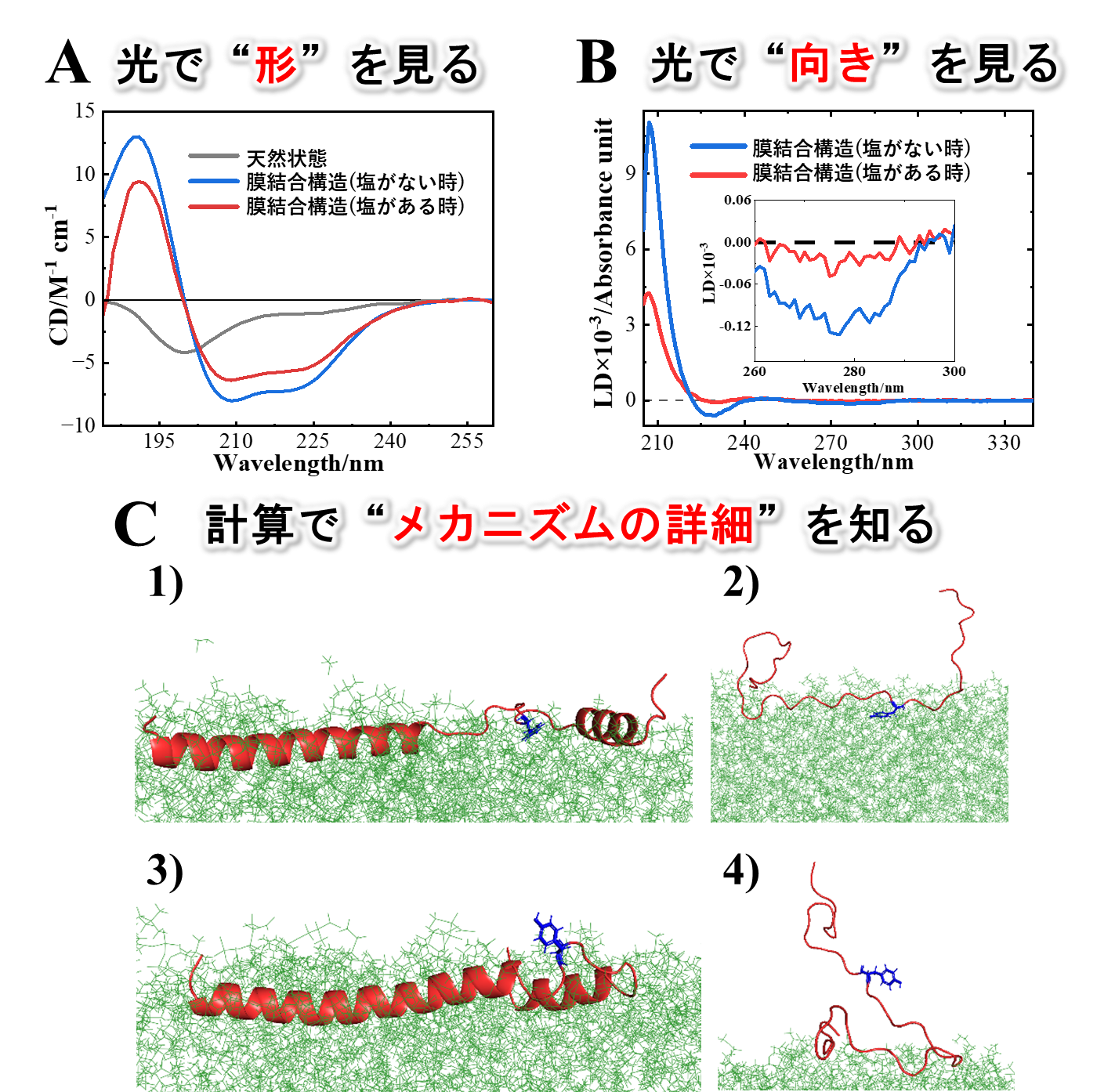
図4 (A) 天然構造(灰色)、膜結合構造(青色:塩がない時、赤色:塩がある時)の円二色性スペクトル (B)αSの膜結合構造(青色:塩がない時、赤色:塩がある時)の直線二色性スペクトル。挿入図は280nm付近(チロシン残基由来のシグナル)を拡大したもの (C)(1,3)αSの1-60番目のアミノ酸領域(青色はチロシン残基:Y39)と(2,4) 96-140番目のアミノ酸領域(青色はチロシン残基:Y125)の生体膜との相互作用についてのMDシミュレーションの結果
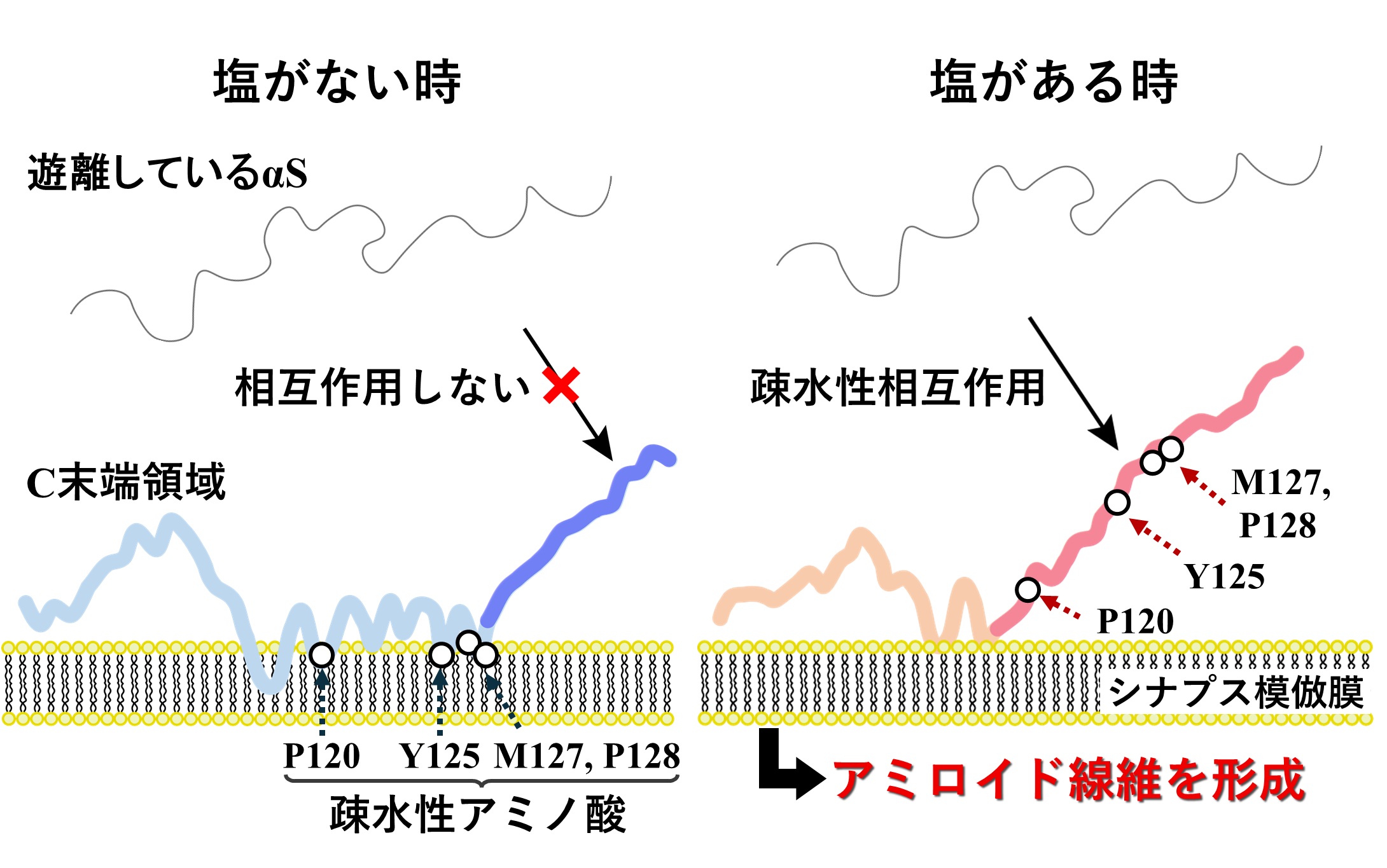
図5 本研究結果をもとに提案されたαS(96-140番目のアミノ酸領域)の膜結合構造と線維形成を促進させる分子間相互作用のモデル。塩の影響により、水を避ける性質を持つアミノ酸残基(Y125等)を多く含む領域が、溶媒に露出すると、遊離しているαSとの分子間相互作用を誘発し、アミロイド線維形成が促進される。
本研究では、実験と理論計算を組み合わせることで、パーキンソン病の誘発物質であるアミロイド線維が形成される前の小胞模倣膜と結合したαSの分子構造を明らかにすることで、線維形成において重要な領域が96-140番目のアミノ酸領域にも存在することを明らかにしました。本研究成果は、生体膜上のαSの構造とアミロイド線維形成との関係を分子レベルで解明するものです。アミロイド線維が関連する疾患を制御する研究に応用でき、アルツハイマー病や筋萎縮性側索硬化症など疾病メカニズムの解明や治療戦略に貢献することが期待されます。
注1 放射光
ほぼ光速で運動する電子の進行方向が磁石によって変えられた際に発生する電磁波であり、シンクロトロン放射とも呼ばれます。赤外からX線にわたる広い波長の電磁波を含む強力な光源であり、固体物理や生体物質構造研究をはじめ、物理・生物・化学など幅広く利用されています。
注2 真空紫外円二色性分光
たんぱく質などの生体分子は、三次元の図形や物体が、その鏡像と重ね合わすことができないキラリティと呼ばれる性質を持ちます。キラリティがある分子は、左円偏光と右円偏光と呼ばれる特殊な光の吸収量に差があり、それを円二色性と呼びます。光の波長を変えながら円二色性の大きさや符号を測ったものを円二色性スペクトルと呼びます。円二色性スペクトルの形状はタンパク質の二次構造を敏感に反映するので、塩や生体膜存在下などの様々な条件で測定した円二色性スペクトルを比較することで、たんぱく質の構造がどのように変化したのかを知ることができます。本研究で用いた真空紫外円二色性分光は、光源に放射光を用いており、市販の装置では測定困難な高エネルギー領域である真空紫外領域まで円二色性スペクトルの測定範囲を広げることが可能であり、タンパク質の二次構造について詳細な情報を得ることができます。
注3 直線二色性分光
直線二色性とは物質に直線偏光を照射し、垂直と平行の偏光に対して吸収の差が生じる現象のことを指します。たんぱく質が生体膜と結合するとき、しばしば特定の方向を向いて並び、これを配向と呼びます。配向は、たんぱく質の機能に重要であり、分子の形状や電荷分布、膜との相互作用によって決定されます。例えば、ヘリックス構造を持つたんぱく質は、その二次構造の配向に依存して異なる直線二色性スペクトルを示し、分子が膜の面に対して平行か垂直かといった情報を得ることが出来ます。
注4 分子動力学(MD)シミュレーション
原子や分子の動きを計算により導き出すコンピュータシミュレーションの手法です。近年では、コンピュータの性能向上やソフトウェアのアルゴリズムの改良により、生体分子などの高分子の長時間シミュレーションが可能になりつつあります。
注5 アミロイド線維
アミロイド線維は、たんぱく質が正しく折りたたまれずに異常に集まってできた不溶性かつ繊維状の物質です。細胞にとって有害で、神経細胞などの働きを妨げることがあり、多数集合すると細胞にダメージを与え、病気を引き起こします
注6 パーキンソン病
パーキンソン病は歩行しにくくなるなどの運動障害をもたらす神経系の難病です。パーキンソン病患者の脳内にはレビー小体というたんぱく質と脂質の特徴的な凝集体が存在することはわかっています。
注7 筋萎縮性側索硬化症
筋萎縮性側索硬化症(ALS)は、体の筋肉を動かすために必要な神経が徐々に働かなくなっていく神経系の難病です。ALSではいくつかのたんぱく質が正しく折りたたまれず、異常に蓄積します。これが神経細胞を傷つけ、最終的に筋肉を動かす信号がうまく伝えられなくなります。
注8 二次構造
たんぱく質はそれぞれ異なる構造をしていますが、局所的に見ると、類似した構造が見られます。このたんぱく質が共通して持っている構造のことを二次構造と呼んでいます。代表的な二次構造として、ヘリックス(らせん構造)やストランドあるいはシート(平面的な構造)があります。決まった二次構造をたんぱく質がとらない場合、その構造はランダムコイルとして分類されます。
注9 ThT蛍光測定
ThT蛍光測定は、アミロイド線維の量を調べるための方法です。ThT(チオフラビンT)という蛍光色素は、アミロイド線維と結びつくと光を放つ性質を持っています。この性質を利用して、アミロイド線維がどのくらいあるかを蛍光で測定することができます。
放射光科学研究所
准教授 松尾 光一(まつお こういち)
Tel:082-424-6293 FAX:082-424-6294
E-mail:pika@hiroshima-u.ac.jp
大学院先進理工系科学研究科物理学プログラム
大学院生 今浦 稜太(いまうら りょうた)
Tel:082-424-6293 FAX:082-424-6294
E-mail:d220926@hiroshimia-u.ac.jp
掲載日 : 2024年10月24日
Copyright © 2003- 広島大学