〈研究に関すること〉
広島大学大学院統合生命科学研究科 佐藤 明子 教授
TEL:082-424-6507 FAX:082-424-0759
E-mail:aksatoh@hiroshima-u.ac.jp
〈広報・報道に関すること〉
広島大学 広報室
TEL:082-424-6762
E-mail:koho@office.hiroshima-u.ac.jp
理化学研究所 広報部 報道担当
TEL:050-3495-0247
Email: ex-press@ml.riken.jp
広島大学大学院統合生命科学研究科の佐藤明子 教授、理化学研究所光量子工学研究センターの中野明彦 客員主管研究員、戸島拓郎 上級研究員らは、ビオチンを細胞に入りやすい形に改良したビオチン誘導体 (ビオチンメチルエステル: BME)(※5)を用いることで細胞内への迅速なビオチンの誘導に成功しました。
私達が生きるために必須なビタミンの一種である「ビオチン」は、卵白に含まれる「アビジン(※3)」と呼ばれるタンパク質と強く結合する性質を持つため、現在、さまざまなバイオテクノロジー技術に用いられています。ビオチンはナトリウム依存性マルチビタミントランスポーター (SMVT)(※4) と呼ばれるタンパク質の働きで細胞内に取り込まれます。しかし、私達は多くの細胞でSMVTによるビオチン取り込みに時間がかるため、生細胞内へのビオチン投与を必要とするバイオテクノロジー技術が迅速に機能しないことを発見しました。
さらに、BMEは細胞内でビオチンへと急速に加水分解(化学反応によって物質が水の働きで分解され、元の成分に戻る反応)され、細胞内のビオチン濃度を迅速に上昇させることで、バイオテクノロジー技術を改良できることを発見しました。また、最近の研究から、SMVTの欠損が、マルチビタミン反応性遺伝性代謝異常症(multivitamin-responsive inherited metabolic disorder)を引き起こすことが分かってきました。私達の研究成果は、BMEがビオチンのプロドラッグ(※6)として機能することを示しており、マルチビタミン反応性遺伝性代謝異常症の患者さんへのビオチン供給を促進する可能性があり、治療への応用が考えられます。
掲載雑誌名: Communications Biology
論文名: Biotin methyl ester enhances cargo release in RUSH system and enables rapid biotinylation with TurboID
著者名: Uehara T1#, Takiguchi A1#, Tojima T2, Nakano A2, 3, Kagawa S1, Nehira T1, Satoh T1, Satoh AK1,*.
所属:1)広島大学大学院 統合生命科学研究科
2)理化学研究所 光量子工学研究センター
生細胞超解像イメージング研究チーム(研究当時、現画像情報処理研究チームの所属)
3)東京科学大学 総合研究院高等研究府
# 共筆頭著者:上原 大政・瀧口 新
* 責任著者:佐藤 明子
DOI: 10.1038/s42003-025-09176-4.
掲載日時: 2025年12月16日
ビオチンは私達が生きるために必須なビタミンの一種です。私達は自身でビオチンを合成することはできないため、ビオチンを食事により取り入れる必要があります。ビオチンの細胞内への取り込みは、細胞膜に存在するナトリウム依存性マルチビタミントランスポーター (SMVT) が行っています。
ビオチンはアビジンと強い結合を示すことから、ビオチン・アビジン結合性を利用したさまざまなバイオテクノロジー技術が発達しています。さらに、近年、近位依存性ビオチン化酵素(※7)を用いたタンパク質相互作用の網羅的解析(近位依存性ビオチン標識法(※8))が活発に進められています。生きた細胞でこれらの技術を用いる場合には、細胞培養液へのビオチン投与で十分であると考えられてきました。
細胞内における物質輸送(膜交通)の研究分野では、ビオチン投与によりタンパク質輸送を開始できる同調的輸送開始実験法 (Retention Using Selective Hook 法: RUSH) 法(※9)が汎用されています。しかし、私達は、RUSH法において、ビオチン投与後すぐには輸送開始しない細胞が多いことを報告していました (Tago et al., EMBO repo, 2025)( https://www.hiroshima-u.ac.jp/news/87904)。今回、私達は、この理由がビオチンの細胞内取り込みが迅速ではないからではないかと考え、実験を行いました。
本研究では、ビオチンの膜透過性を向上させる目的で、ビオチンのカルボキシ基を保護したビオチン誘導体 (ビオチンメチルエステル: BME) を用いてRUSH法においてタンパク質輸送が迅速に開始するかを評価しました。その結果、RUSH法において推奨されている40μMにおいてビオチンが十分な輸送開始を引き起こせないのに対して、BMEでは、その20分の1の濃度である2μMの投与でもタンパク質輸送が迅速に開始することを示しました。また、BMEの細胞内への取り込みはSMVTの阻害剤では阻害されず、BMEが直接細胞膜を透過することが強く示唆されました。
さらに、BMEが近位依存性ビオチン化酵素によるビオチン化の速度も上昇させることを発見しました。ビオチン化酵素はBMEを直接基質として利用できないことから、この結果はBMEが細胞内で急速に加水分解されることを強く示唆しています。また、細胞内の核・細胞質ゾル・小胞体内腔のいずれの領域においても、BME投与が近位依存性ビオチン化酵素によるビオチン化を活性化することを示しました。これらの結果から、BMEがビオチンを用いるバイオテクノロジー技術を大きく改良できると結論しました。
本研究が示した「BMEによる細胞内への迅速なビオチン供給」は、ビオチンを利用するさまざまなバイオテクノロジー技術全般に普及するものと考えられます。
また、ビオチンは私達が生きるために必須なビタミンの一種です。私達は自身でビオチンを合成することができないため、ビオチンを食事により摂取し、細胞内に取り込んでいます。最近の研究から、ビオチンの細胞内への取り込みに必要なSMVTの欠損が、マルチビタミン反応性遺伝性代謝異常症(multivitamin-responsive inherited metabolic disorder)を引き起こすことが分かってきました。BMEはビオチンのプロドラッグ(体内で活性成分に変化して働く薬)として機能することから、代謝マルチビタミン反応性遺伝性代謝異常症を含むビオチン代謝異常症の患者へビオチン供給を簡単に行うことができる可能性があり、治療への応用が考えられます。
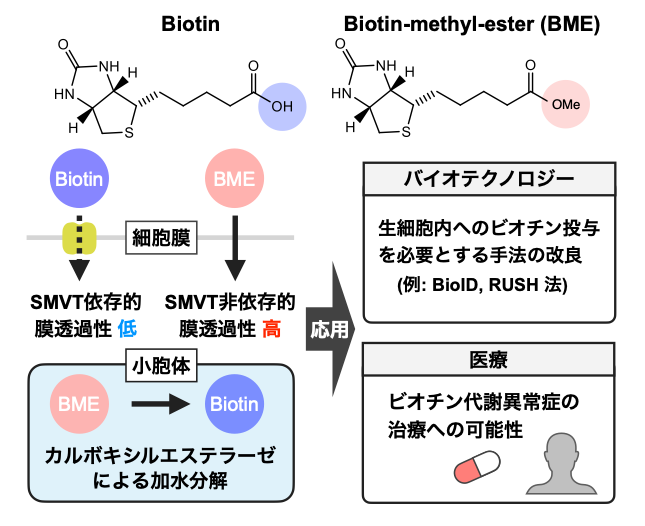
図 ビオチンメチルエステル (BME)による細胞内への迅速なビオチン供給と応用
BMEはビオチンのカルボキシル基がメチル化された、電荷を持たない小分子であり、容易に細胞膜を通過する。小胞体内腔において、カルボキシルエステラーゼの働きで加水分解されてビオチンとなる。小胞体膜は電荷を持った小分子も容易に通すため、BME投与により細胞質ゾル・核・小胞体のいずれの領域にもビオチンを迅速に供給でき、バイオテクノロジー技術を改良できる。さらにビオチン代謝異常症の治療に役立つ可能性がある。
(※1)ビオチン
ビタミンB群の一種であり、エネルギー代謝や皮膚・粘膜・髪・爪の健康維持に重要な役割を果たす水溶性ビタミン。体内で糖質、アミノ酸、脂質の代謝を助ける補酵素として働く。
(※2) マルチビタミン反応性遺伝性代謝異常症
SMVTの欠損によって引き起こされる先天性代謝異常症の1つであり、最近同定された疾患。ビオチンがカルボキシラーゼの補酵素であるため、患者はマルチプルカルボキシラーゼ欠損症と呼ばれる病態を含む多様な症状を示す。
(※3)アビジン
卵白に存在する糖タンパク質で、ビタミンであるビオチンと非常に強く結合する性質を持ちます。この強力な結合を利用して、生命科学分野では、様々なバイオテクノロジー技術に利用されています。
(※4) ナトリウム依存性マルチビタミントランスポーター (SMVT)
ビオチン・パントテン酸・リボ酸塩の細胞内への取り込みに機能する細胞膜タンパク質。濃度勾配に従ってナトリウムを細胞内に取り込むときにこれらのビタミンを同時に輸送するシンポーター。
(※5) ビオチンメチルエステル (BME)
ビオチンのカルボキシル基がメチル基とエステル結合したビオチン誘導体。電荷を持たない小分子であり、カルボキシルエステラーゼにより分解される。
(※6) プロドラッグ
機能分子(ドラッグ)のカルボキシ基がエステル化された分子。電荷を持たないため迅速に細胞膜を透過する。細胞内に入るとカルボキシルエステラーゼにより加水分解され、活性を持つドラッグとして機能する。
(※7) 近位依存性ビオチン化酵素
大腸菌ビオチンリガーゼ酵素BirA に変異を導入し、中間体のbiotinyl-5’-AMP が酵素から遊離し,近傍のタンパク質のリジン残基にビオチンを付加するように改変した酵素BirA* (BioID) やそれを改良したもの等。活性を高めたTurboID, AirID などがよく利用される。
(※8) 近位依存性ビオチン標識法
以下の一連の操作により、相互作用ネットワークを解析する手法。相互作用ネットワークを知りたいタンパク質に、近位依存性ビオチン化酵素を融合して発現させる。細胞にビオチンを投与することで、興味あるタンパク質近傍に存在するタンパク質を網羅的にビオチン化する。ビオチン化タンパク質をアビジンカラムで精製し質量分析機で解析することで相互作用ネットワークを明らかにできる。
(※9) 同調的輸送開始実験法 (Retention Using Selective Hook法: RUSH法)
膜交通分野で汎用されるタンパク質輸送を同調的に開始させる手法。ビオチン投与によりタンパク質がアビジンから遊離して輸送を開始する。
〈研究に関すること〉
広島大学大学院統合生命科学研究科 佐藤 明子 教授
TEL:082-424-6507 FAX:082-424-0759
E-mail:aksatoh@hiroshima-u.ac.jp
〈広報・報道に関すること〉
広島大学 広報室
TEL:082-424-6762
E-mail:koho@office.hiroshima-u.ac.jp
理化学研究所 広報部 報道担当
TEL:050-3495-0247
Email: ex-press@ml.riken.jp
掲載日 : 2025年12月23日
Copyright © 2003- 広島大学