広島大学ゲノム編集イノベーションセンター 特任准教授 栗田 朋和
Tel:082-424-4008
E-mail:kuri616*hiroshima-u.ac.jp
(*は半角@に置き換えてください)
本研究成果のポイント
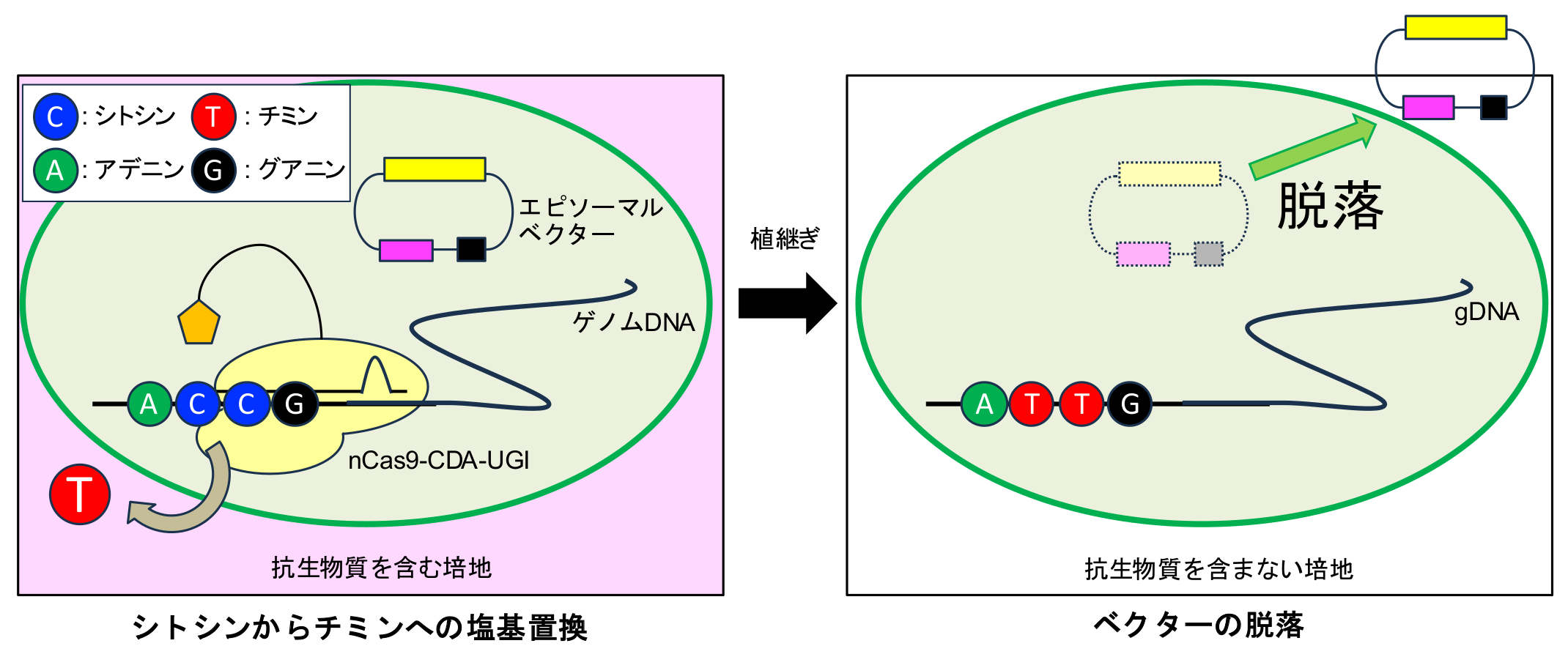
- バイオディーゼルなどの燃料生産が期待される微細藻類“ナンノクロロプシス*1”において、遺伝子を安全に改変できるよう「塩基編集*2システム」を搭載した脱落可能なDNAベクターを開発しました。
- この塩基編集システムは、DNA二本鎖切断(DNA Double-strand Breaks, DSBs)*3を導入しない安全な遺伝子改変システムであるため、外来遺伝子を残さず(外来遺伝子フリー*4)、必要な変異だけを導入できる安全な方法です。この技術を使うことで、遺伝子改変後も外来遺伝子を含まないナンノクロロプシスを構築することが可能になりました。
- 脱落可能なベクターにより樹立できる外来遺伝子の残らないゲノム編集生物はカルタヘナ法*5の定める遺伝子組換え生物には該当しないため、屋外培養などの幅広い用途への応用が期待できます。
概要
広島大学ゲノム編集イノベーションセンターの諸井桂之研究員、山本卓教授および栗田朋和特任准教授は、非常に多くの油脂を蓄積する微細藻類、ナンノクロロプシスにおいて脱落可能な塩基編集ベクターを開発しました。この技術により変異導入時にDSBsを介さずに外来遺伝子を含まないナンノクロロプシスのゲノム編集株を樹立する手法を確立しました。
本研究成果は令和7年11月27日に英国Nature research社の科学雑誌「Scientific Reports」に掲載されました。
論文情報
掲載雑誌:Scientific Reports
論文題目:“Double-strand break-free and transgene-free genome editing in the microalga Nannochloropsis oceanica using removable vectors containing the CRISPR base editing system”
著者: Keishi Moroi, Yamamoto, Tomokazu Kurita*
広島大学ゲノム編集イノベーションセンター
*:責任著者
DOI: 10.1038/s41598-025-26657-y
背景
微細藻類は細胞内に多量の油脂や有用物質を蓄積させるため、バイオディーゼルなどの生産が期待されていますが、生産コストなどの面で課題があるため、多くの研究者が微細藻類の分子育種を進めています。現在までに非常に効率の良いゲノム編集ツールが微細藻類で使用されて多くのゲノム編集藻類が構築されましたが、それらはDNA二本鎖切断(DSBs)を導入してから藻類細胞のDSB修復機構依存的に変異を導入していました。一方でこのようなDNAの二本鎖切断が稀に大規模なゲノムDNAの削除や染色体間での組換えなど宿主細胞に有毒で不都合な改変も起こっていました。
研究成果の内容
本研究ではナンノクロロプシスにおいてCEN/ARS*6を含む脱落可能ベクターに塩基編集用の発現カセットを搭載して、図のように塩基置換後に脱落可能なベクターを構築しました。この塩基編集ベクターによりナンノクロロプシスの内在性の5種の遺伝子における6つの標的サイトにおいて塩基置換の導入に成功しました。塩基置換効率は29.2%から47.6%で、塩基置換後のベクターの脱落にも成功しました。
今後の展開
本研究により確立したDSBフリー且つ、外来遺伝子が残らないゲノム編集法を用いて屋外培養可能、かつ油脂蓄積効率の高い“高機能藻類”の樹立が期待されます。DSBフリーのゲノム編集システムは複数箇所同時改変でも標的サイト間での大規模な遺伝子の脱落や染色体間での組換えといった不都合な改変が起こり難く、また脱落可能ベクターはマーカーの再利用が可能になるため、本システムは、細胞内の多数の遺伝子を改変する際に非常に有効であると考えられます。本研究で確立した外来遺伝子フリー塩基編集システムは藻類バイオディーゼル*7の実用化に必須の基盤技術と考えられます。
用語解説
*1 ナンノクロロプシス
直径 2〜5μmほどの小さな海の植物プランクトンです。培養環境に応じてバイオディーゼルに変換できる油脂を大量に蓄積すること、オメガ3脂肪酸のEPA(エイコサペンタエン酸)を豊富に含有することなど多くの特長を持つことから、さまざまな分野で活用されています。
*2 塩基編集
Clustered regularly interspaced short palindromic repeats (CRISPR)–CRISPR-associated protein 9 (Cas9)には2つのヌクレアーゼドメインがあり、標的部位にDNA二本鎖切断を導入します。このヌクレアーゼの片方を失活したnCas9はDNAの2本鎖の片方のみを切断する酵素でCas9ニッカーゼと言います。このnCas9に塩基の脱アミノ化を行うデアミナーゼを融合して、標的部位の塩基を別の塩基に置換するのが塩基編集です。本研究では、nCas9にヤツメウナギのデアミナーゼであるPmCDA1とウラシルDNAグリコシレーション阻害タンパク質を結合した融合タンパク質を使用しています。PmCDA1は標的配列のシトシンのアミノ基を脱離させてウラシルに置換します。ウラシルはチミンと同様にアデニンと塩基対を形成するため、最終的にシトシンをチミンに変換できます。このような塩基編集システムをシトシンベースエディター(cytosine base editors, CBE)と言います。ウラシルDNAグリコシレーション阻害タンパク質はPmCDA1により変換されたウラシルが細胞内の塩基除去修復機構により取り除かれ、別の塩基に変換されるのを防ぐ役割があります。
*3 DNA二本鎖切断(DNA Double-strand Breaks, DSBs)
生命の設計図であるゲノムDNAは二本のDNA鎖が二重螺旋構造を形成していますが、この二本の鎖の両方を切断するのがDSBsです。DSBsが導入されると細胞内のDSB修復系が機能し基本的には元通り修復されます。しかし一定の割合で修復システムのエラーによりゲノムDNAに変異が導入されます。この現象を利用してDSBsを介したゲノム編集ツールは特定部位に結合してDSBsを導入、標的遺伝子に変異を導入しますが、この時に稀に標的以外の遺伝子を含む大規模な遺伝子の削除や、染色体間での置換など、宿主細胞にとって有害で不都合な反応が起こることがあります。このような反応は特に特にゲノムDNAの複数の場所でDSBsを同時に導入した場合に起こることがあるため、複数の遺伝子を同時に改変する場合には特にDSBフリーのシステムが重要になります。
*4 外来遺伝子フリーシステム
異種生物由来や合成された配列など、外来のDNA配列を含む生物を遺伝子組換え生物(Gene Modified Organisms, GMOs)と言います。GMOsはカルタヘナ法に基づく生物学的封じ込めの規定があるため、屋外培養などには非常に強い使用制限があります。CEN/ARSを持つベクターは細胞内でゲノムDNAの外で維持されるエピソーマルベクターとして振舞い、抗生物質による選択圧が無い培養条件では自然に脱落します。このように最終的に外来遺伝子が残らないシステムを外来遺伝子フリーシステムと言います。
*5 カルタヘナ法
遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律。日本国内において、遺伝子組換え生物の使用等について規制をし、生物多様性条約カルタヘナ議定書を適切に運用するための法律で、遺伝子組換え生物が生物多様性へ影響を及ぼさないかどうか事前に審査することや、適切な使用方法について定められています。
*6 CEN/ARS
出芽酵母の染色体の安定性に関わる配列であり、CEN/ARSはCentromere and autonomous replication sequenceの略で、出芽酵母の汎用low copyベクターに使用されています。最近このCEN/ARSを持つベクターが珪藻やナンノクロロプシスにおいても細胞内でゲノムDNAの外でエピソーマルベクターとして安定に維持されることが報告されていました。
*7 藻類バイオディーゼル
微細藻類は環境ストレスなどに応じて細胞内に多量の油脂を蓄積します。この油脂に含まれる脂肪酸を脂肪酸メチルエステルに変換して使用する燃料です。藻類による油脂の生産は光合成によりCO2を吸収するため、大気中のCO2を増加させない次世代の再生可能エネルギーとして期待されています。

 Home
Home