TEL: 082-257-5280
E-mail: sugi*hiroshima-u.ac.jp
(注:*は半角@に置き換えてください)
本研究成果のポイント
環状構造を持つD-サイクロセリン(D-CS)は、肺への移行性が高いことと、既存の抗生物質に耐性を示す結核菌に有効であることから、結核の二次選択薬として使用されています。
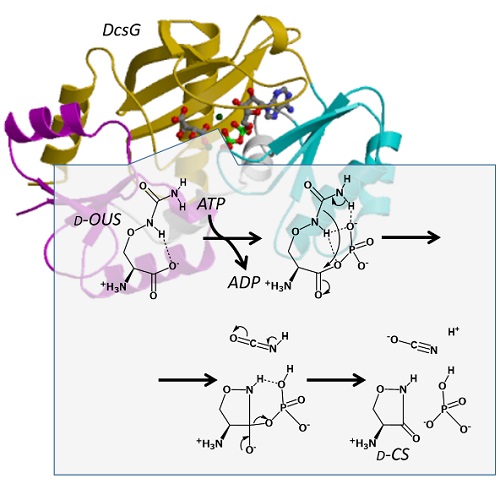
今回の研究成果として、D-CSの生合成に関与するDcsG酵素の立体構造決定に成功するとともに、その立体構造に基づいて、ATP存在下で基質を環状化する酵素の触媒機構を明らかにすることができました。
本研究成果からは、以下の応用が考えられます。
- 環状構造を持つペプチドはエキソ型ペプチド分解酵素から保護されることから、DcsGは分解されにくい生理活性ペプチドの合成に使用できる可能性があります。
- DcsGの反応機構を応用し、蛍光剤をタンパク質に付加することが期待できます。
概要
ATP-graspモチーフを持つ酵素は、通常、2つの基質をアミド結合で連結する反応を触媒しますが、DcsGは分子内でアミド結合を形成することが特徴です。今回、杉山研究グループの一員で、安田女子大学に移籍した的場康幸准教授が中心となり、DcsGの三次元構造を解析し、その触媒機構を原子レベルで解明しました。
本研究成果は「The FEBS Journal」オンライン版に掲載されました。
論文情報
- 掲載誌:The FEBS Journal
- 論文タイトル: Cyclization mechanism catalyzed by an ATP‐grasp enzyme essential for D-cycloserine biosynthesis
- 著者名: 的場康幸、宇田成利、工藤真子、杉山政則
- DOI: doi:10.1111/febs.15163
- 報道発表資料(305.26 KB)
- 論文掲載ページ (The FEBS Journalに移動します)
- 広島大学研究者総覧 (杉山 政則 共同研究講座教授)
- 大学院医系科学研究科未病・予防医学共同研究講座
【お問い合わせ先】
広島大学大学院医系科学研究科
未病・予防医学共同研究講座教授 杉山 政則

 Home
Home