<研究に関すること>
(株)国際電気通信基礎技術研究所(ATR) 経営統括部 企画・広報チーム
TEL: 0774-95-1176
E-mail: pr*atr.jp (注: *は半角@に置き換えてください)
<AMEDの事業に関すること>
国立研究開発法人日本医療研究開発機構 疾患基礎研究事業部 疾患基礎研究課
戦略的国際脳科学研究推進プログラム
TEL: 03-6870-2286
E-mail: brain-i*amed.go.jp (注: *は半角@に置き換えてください)
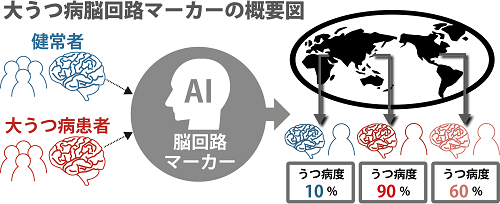
山下歩研究員らATR脳情報通信総合研究所、広島大学、東京大学、昭和大学、京都大学、山口大学、理化学研究所の研究グループは、人工知能技術を駆使することで、機能的磁気共鳴画像(fMRI)データに基づいて撮像施設によらず有効な大うつ病の脳回路マーカーを世界に先駆けて開発しました。また株式会社XNef[*]酒井雄希副社長らは、本技術を臨床現場で実用化するために、医療機器の承認審査機関である独立行政法人医薬品医療機器総合機構(PMDA)(※1)と3年にわたり相談し、2022年度中の医療機器プログラムとしての承認取得を目指しています。
これまで生物学的な検査は精神医学の臨床現場での診断にほとんど利用されておらず、神経科学が役立つ例は多くありませんでした。特に、fMRIはその安全性や情報量の多さから、実用化の期待は高かったのですが、計測した施設によってデータの性質が異なるという、実用上の極めて大きな困難がありました。例えば、1施設で撮像された数十人程度のfMRIデータに人工知能技術を適用して得られた脳回路マーカーは、他の施設では役に立ちません。世界中のどの施設でも使える脳回路マーカーの開発は、これまで実現されていませんでした。
本研究では、まず、研究グループが昨年開発したハーモナイゼーション(調和)法(※2)に基づき、異なる複数施設で取得したfMRIデータを、施設間差を除去した均質な大規模データ(総数1,584例)として統合しました。次に、この調和された大規模データに対して、人工知能技術である機械学習法を適用して、個人の脳回路に基づき健常者と大うつ病患者を判別する、大うつ病の脳回路マーカーを開発しました。この脳回路マーカーは、異なる施設で撮像された完全独立データについても健常者と患者を約70%の確率で判別でき、施設に関係なく有効であることを確認しました。
XNef社は、ATR、広島大学、AMEDと連携しながら、本研究で発表したうつ病脳回路マーカーに関して、医療機器プログラムとして実用化するために、現在までに医療機器開発前相談(※3)を含め7回の相談をPMDAと行い、うつ病脳回路マーカーの開発方針に関してコンセンサスを得ています。今後もさらにPMDAとの相談を継続することで、品質の確保された医療機器開発・承認申請資料の準備を行い、2021年度にはうつ病脳回路マーカーの承認申請を行い、2022年度中の承認取得、最終的には保険適用され、実臨床で広く利用されることを目指しています。
[*] 株式会社XNef:株式会社XNefは、これまでの脳科学研究戦略推進プログラム、戦略的国際脳科学研究推進プログラムにおける精神神経疾患の診断と治療技術に関する研究開発成果を実用化するために2017年に設立されたベンチャー企業です。
人間の脳は巨大な情報ネットワークと見なすことができます。このネットワークは、遺伝で大まかな構造が決まり、さまざまな経験をすることで、個人に固有なネットワークが形作られます。最近では、わずか5〜10分間安静にしているときの脳活動(安静時脳活動)をfMRIで計測するだけで、その人の脳内の領域同士がどのように繋がっているかを解読できるようになりました。これは、個人に特有な脳の配線図とも言えます。fMRIは多くの臨床現場で使用されているMRIを用いることで取得可能な脳画像データであり、その安全性や情報量の多さから、臨床応用が以前から期待されていました。実際に、機械学習法による人工知能がこの脳の配線図を読み取ることで、患者の診断や患者に有効な治療法を予測することが可能になってきました(※4)。しかしながら、これまでの目覚ましい発展にもかかわらず、これらの技術が臨床の現場で実用化されるケースはありませんでした。
これまでの多くの研究では、1施設で数十人程度のfMRIデータから計算された脳の配線図と機械学習法を組み合わせることで、患者の診断予測などを行ってきました。しかしながら、これらの研究成果を用いて、他施設で得られたfMRIデータから診断予測をしてもほとんど再現できないことがわかってきました。この原因は、少数のデータサンプルで、多くの要因が関与するデータ(脳画像)の背後にある法則を学習しようとすると、機械(コンピュータ)はそのデータサンプルだけにしか通用しない特殊なことを学習してしまう「過学習」という現象が起きるからであると考えられています(※5)。過学習を避けるには、多くのfMRIデータが必要になりますが、ひとつの施設で集められる被験者には限りがあります。そこで、複数の施設が協力してデータを集めることが必要になります。しかし、同じfMRIデータであっても、計測した施設によってデータの性質が全く異なってしまうという施設間差の問題がありました。本研究グループは、昨年度PLOS Biology誌で発表したように、この施設間差の問題を独自のハーモナイゼーション法(施設間差を除去して均質なデータセットとして統合する方法)(※2)を開発することで解決しました。今回は、このハーモナイゼーション法に基づいて、異なる複数の施設から収集されたデータを調和されたひとまとまりの大規模データ(総数1,584例)として解析することができました。本研究ではこの大規模データに対して人工知能技術である機械学習法を適用することで、個人の脳回路に基づき健常者と大うつ病患者を判別する、大うつ病の脳回路マーカーを開発しました。この脳回路マーカーを用いることで、どこの施設で撮像されたfMRIデータを用いたとしても、個人の脳の配線図から健常者と大うつ病患者を約70%の確率で判別することが可能となり、実用化に向けて大きく前進しました。
AMED脳科学研究戦略推進プログラムの脳画像データベースプロジェクトの一環として、脳プロ統一プロトコル(※6)と呼ばれるある程度均質な手法に基づいて、国内4施設(広島大COI・京都大・東京大・昭和大)の研究参加者713人(健常者564人、うつ病患者149人)の安静状態における脳活動を、各施設のfMRI装置を用いて10分間計測し、全部で713サンプルを取得しました(発見用データセット)(図1)。脳を379個の小領域に分割し、ひとりひとりについて各領域における機能的MRI信号の時間波形を取り出し、それらが任意の2領域間でどの程度似ているか相関係数として数値化しました。これを領域間機能的結合(※7)と呼びます(図2)。379個の小領域の全てのペア(71,631個)について機能的結合を計算することで、個人の脳全体の回路を定量的に調べ、全脳の配線図(=71,631個の数値からなるベクトル)が作成されます。これを参加者全員分について求め、人工知能技術(※8)を適用することで研究参加者が大うつ病患者なのか健常者なのかを見分ける「大うつ病脳回路マーカー」を作成しました。この脳回路マーカーでは全脳の配線図から個人のうつ病度を数値化し、その大小で大うつ病患者を自動判別します(図2)。その結果、713人の健常者・うつ病患者を66%(AUC(※9) = 0.74)の精度で判別することができました(図3)。さらに、この脳回路マーカーがどこの施設で撮像した脳画像データに対しても有効かを調査するために、国内4施設(梶川病院・広島市総合リハビリテーションセンター・広島大病院・山口大学)及び一般公開されている国外施設(https://openneuro.org/datasets/ds002748/versions/1.0.0)の研究参加者521人(健常者285人、うつ病患者236人)の安静状態における脳活動データを収集し、全部で521サンプルを取得しました(検証用データセット)(図1)。その結果、521人の健常者・うつ病患者を66%(AUC = 0.74)の精度で判別することができました(図3)。また、同時に人工知能に基づいてうつ病診断に重要な結合を特定することに成功しました(図3)。
本研究成果をうつ病診断の参考情報として実用化するためには、安全性・有効性を確認した上で、医療機器として承認を受ける必要があります。基礎研究から実用化に向けては様々な課題があり、課題解決には審査当局との密な相談が重要です。そのため、医療機器の承認審査機関であるPMDA(医薬品医療機器総合機構)(※1)と、医療機器の開発早期から相談を開始することが、着実・円滑な薬事承認(※10)へとつながります。
XNef社は、ATR、広島大学、AMED等と連携しながら、本論文で発表したうつ病脳回路マーカーに関して、医療機器プログラムとして実用化するために、医療機器開発前相談を含め7回の相談をPMDAと行い、うつ病脳回路マーカーの開発方針に関してコンセンサスを得ています。今後もさらにPMDA相談を継続することで、品質の確保された医療機器開発・承認申請資料の準備を行い、2021年度にはうつ病脳回路マーカーの承認申請を行い、2022年度中の承認取得、最終的には保険適用され、実臨床で広く利用されることを目指しています(図4)。
今回開発した方法の臨床応用のイメージは、以下の通りです。精神科における一般診療として広く行われている器質的因子除外のためのMRI撮像に加えて、10分間程度のfMRI撮像を行います。このデータをもとに、医師が院内に設置された専用端末のプログラムを操作することで、XNef社が運営管理する院外の解析処理サーバーに脳画像を送付して自動的に解析が行われ、うつ病脳回路マーカーの解析結果が端末側プログラムに表示されます。うつ病の臨床診断は、通常、問診から得られた臨床症状の経過・表情・質問への回答の様子などから推察される思路など複数存在する情報から診断基準に基づき決定されますが、本医療機器は判断指標の一つを提供するものとして、医師が解析結果を参考情報として臨床的判断を行い、治療を開始することを可能にします。
本研究の成果は、安静状態の領域間機能的結合つまり脳の配線図という生物学的な指標を用いて、精度の高いうつ病の脳回路マーカーを確立し、その脳回路マーカーがどこの施設で撮像したfMRIデータにも有効であることを示した世界に先駆ける画期的なものです。さらに臨床現場での実用化を見据え、すでにPMDAとの医療機器開発前相談を行い、うつ病脳回路マーカーの開発方針に関してコンセンサスを得ており、スムーズな臨床開発に向け取り組んでいます。
今後もさらにPMDAとの相談を継続することで、安全性・有効性を確認した後に、本研究成果が、うつ病診断の参考情報として広く実用化されることを目指していきます。また、本研究で開発した手法を利用して、大うつ病に限らず統合失調症や自閉スペクトラム症などの脳回路マーカーを世界に先駆けて開発し、精神疾患と発達障害の診断補助及び治療補助に貢献していく予定です。
株式会社国際電気通信基礎技術研究所(ATR)
山下歩,八幡憲明(東京大学・量子科学技術研究開発機構),山田貴志(昭和大学),
酒井雄希(京都府立医科大学),田中沙織,川人光男(理化学研究所 革新知能統合研究センター),
山下宙人(理化学研究所 革新知能統合研究センター),今水寛(東京大学 大学院人文社会系研究科)
広島大学 大学院医系科学研究科
市川奈穂,髙村真広,岡田剛,岡本泰昌
東京大学 大学院医学系研究科
國松聡,岡田直大,笠井清登
昭和大学
板橋貴史,橋本龍一郎,加藤進昌
京都大学
水田弘人,高橋英彦(現: 東京医科歯科大学)
山口大学
山形弘隆,原田健一郎,松尾幸治(現: 埼玉医科大学) *( )内は兼務先もしくは現所属を表記。
本研究は、国立研究開発法人日本医療研究開発機構(AMED)・脳科学研究戦略推進プログラム 『DecNefを応用した精神疾患の診断・治療システムの開発と臨床応用拠点の構築』課題 JP17dm0107044 (代表 川人光男)により取得したデータを使って、「戦略的国際脳科学研究推進プログラム」の『脳科学とAI技術に基づく精神神経疾患の診断と治療技術開発とその応用』課題 JP18dm0307008 (代表 川人光男)が実施した成果です。
一部研究は『縦断的MRIデータに基づく成人期気分障害と関連疾患の神経回路の解明』課題 JP18dm0307002 (代表 岡本泰昌)、『人生ステージに沿った健常および精神・神経疾患の統合MRIデータベースの構築にもとづく国際脳科学連携』課題 JP18dm0307004 (代表 笠井清登)、『非線形動力学に基づく次世代AIと基盤技術に関する研究開発』課題 JP19dm0307009(代表 合原一幸)の研究として行われたものです。
また、研究参画者の一部は、内閣府 総合科学技術・イノベーション会議が主導する革新的研究開発推進プログラム(ImPACT)「脳情報の可視化と制御による活力溢れる生活の実現」、東京大学国際高等研究所ニューロインテリジェンス国際研究機構、日本学術振興会科研費16H06280と 18H01098、18H05302、19H05725の助成を受けています。
(※1) PMDA
独立行政法人医薬品医療機器総合機構の略。「医薬品,医療機器等の品質,有効性及び安全性の確保等に関する法律」(薬機法)に基づく医薬品・医療機器などの審査を業務の一つとして実施します。
(※2) ハーモナイゼーション法
異なった施設で取得したデータを調和させ、均質なデータとする方法。我々は、昨年度PLOS Biology誌で発表したように、複数の施設から集められた脳画像データから測定方法の違いによる施設間差のみを除去するハーモナイゼーション法を開発し、施設間差を3割程度削減することに成功しています。
https: //journals.plos.org/plosbiology/article/comments?id=10.1371/journal.pbio.3000042
(※3) 医療機器開発前相談
開発予定又は途中にある品目、日本に初導入するものなど、開発を目指す医療機器を承認申請するにあたり、どのような評価項目が審査に必要とされるのかといった疑問に対応する相談のこと。
(※4) 機械学習法による脳の配線図からの予測
例えば、脳の配線図のパターンからうつ病患者個人に有効な治療法を予測することが出来ます。
https: //www.nature.com/articles/nm.4246
(※5) 過学習について
fMRIデータから分類を行う場合には、基本的に機械学習が用いられます。機械学習では過学習の問題を避けるために、交差検証法を用いて分類器の評価を行うことが一般的です。交差検証法には、一人の被験者を除いて検証用として用いるleave-one-subject-out cross validationやデータを10分割し、10分の9で学習し、残りの10分の1で検証を行う10-fold cross validationなどがあります。しかし、単一施設から得られた少数のサンプルに対して機械学習を適用すると、分類器の性能を過大評価する「予測のインフレーション」を起こす危険が、精神医学分野でも近年認識されるようになってきました
(https: //www.biologicalpsychiatryjournal.com/article/S0006-3223(13)00457-5/fulltext)。少数のデータに対する機械学習では、学習用データにおける特定の施設のfMRI装置や測定方法、実験者、参加者群などに存在する特定の傾向、あるいはノイズに対して過学習してしまう可能性が高くなります。例えば、脳の解剖画像から自閉スペクトラム症を判別する分類器は、開発に使われた英国の学習用データには感度も特異度も9割以上の高性能を示すが、日本人のデータでは5割になってしまうことが報告されています(Yoshihara et al.)。学習用データとは全く異なる施設と被験者群からなる独立検証コホートで検証していない分類器は、科学的にも実用的にも殆ど意味がないと言って過言ではありません。本研究では、発見用データセットには含まれていない山口大学などの完全に独立な施設で撮像されたデータを用いて汎化検証を行いました。
Yoshihara Y, Sugihara G, Deoni D, et al. Discrimination of autistic adults from Controls using data on Whole-Brain MRI in a Japanese Sample. in The 17th Annual Meeting of the Organization on Human Brain Mapping 26-30 June, 2011.
(※6) 脳プロ統一プロトコルとデータベース
脳科学研究戦略推進プログラム「BMI技術を用いた精神・神経疾患等の治療を行うための機器・技術・システムの開発」の「DecNefを応用した精神疾患の診断・治療システムの開発と臨床応用拠点の構築」課題において、安静状態脳活動計測のプロトコルを決定しました。このプロトコルは、安静状態の脳活動の計測・解析方法に関する50項目以上から成ります(https: //bicr.atr.jp/rs-fmri-protocol-2/)。また、この統一プロトコルを使用し、多施設・多疾患で収集された大規模データ(総数2,409例)を世界的にも貴重なデータベースとして構築しました。このデータベースは、疾患患者988名、健常者1,421名の脳構造画像および脳機能画像、年齢・性別、患者については該当する疾患の診断に用いられる臨床評価尺度から構成されています。全員から多施設・多疾患のデータを研究プロジェクトに参画する研究機関内で共有し・合わせて解析する同意を得ています。このうち、公開の同意を得ている1,828名の安静状態の脳機能結合データ、1,627名の脳画像データと年齢・性別・臨床評価尺度等の情報について、利用を希望する研究者に対して所定の審査を行ったのちに利用可能となる形で公開しています (https: //bicr.atr.jp/decnefpro/data/)。また、脳画像データの非制限公開に同意を得られた1,410名の脳画像データと年齢・性別・臨床評価尺度等の情報については、審査なしで利用可能となる形で公開しています。さらに、多施設で収集したデータの施設間差の補正に有益なトラベリングサブジェクトの脳画像データ(9名、9施設)についても審査なしで利用可能となる形で公開しています。なお、すべてのデータから個人情報と連結する符号を削除し、脳画像データからは顔部分を削除することで、参加者の個人同定が行われないような配慮を行っています。
(※7) 領域間機能的結合
空間的に隔たっている脳領域どうしの活動パターンの同期関係(類似度)を表すもの。脳活動を反映するMRI信号(BOLD信号)の時間的変動の相関係数から評価を行いました。相関係数は、2領域間の脳活動の類似性が高い(=同時に活動が高くなったり低くなったりする)と1に近い値に、互いを抑制しあう関係では(一方の活動性が高いとき、他方の活動性が低いなど)–1に近い値に、互いに関連しないとき0に近い値を取ります。本研究では、379個の各脳部位から信号波形を取り出し、全ての脳部位ペア(71,631個=379×378÷2)について相関係数を求めることで、個人の全脳にわたる機能的結合情報を含んだ脳の機能的回路図を得ました。
(※8) 本研究で使用した人工知能技術
ロジスティック回帰とLASSO (Least absolute shrinkage and selection operation) を組み合わせた機械学習法。LASSOを用いることで(4)で述べた過学習の問題が起こりにくくすることができます。
(※9) AUC
Area under the receiver-operator curveの頭文字をとって略したもの。疾患群・健常群の2値分類を行う手法の精度を評価する指標。0~1の値を取り、1に近づけば近づくほど優れた分類方法であることを表します。
(※10) 薬事承認
日本国内で医療機器の製造販売を行うには、医療機器の品質、有効性や安全性についてPMDAが審査し、厚生労働大臣の承認を受けなければいけません。これは薬機法で定められています。
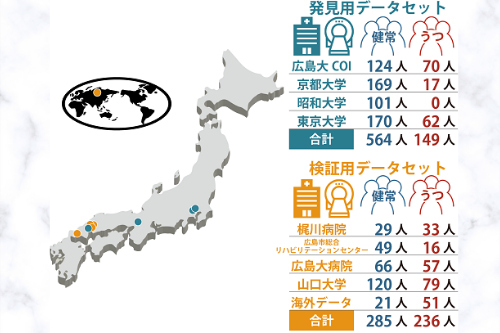
図1: 本研究で使用したデータセットの概要。発見用データセットは国内4施設(広島大COI・京都大・東京大・昭和大)の研究参加者713人(健常者564人、うつ病患者149人)のデータセット。検証用データセットは国内4施設(梶川病院・広島市総合リハビリテーションセンター・広島大病院・山口大学)及び一般公開されている国外施設(https://openneuro.org/datasets/ds002748/versions/1.0.0)の研究参加者521人(健常者285人、うつ病患者236人)のデータセット。
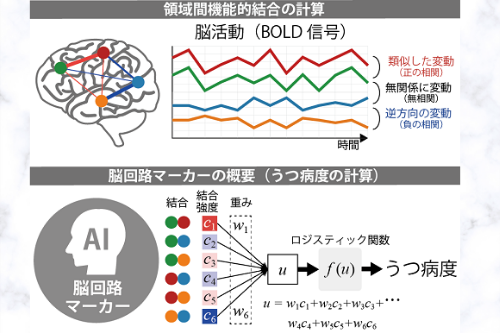
図2: 領域間機能的結合の計算及び脳回路マーカーの概要。脳活動を反映するBOLD信号の時間的変動の相関係数から評価を行う。相関係数は、2領域間の脳活動の類似性が高い(=同時に活動が高くなったり低くなったりする)と1に近い値に、互いを抑制しあう関係では(一方の活動性が高いとき、他方の活動性が低いなど)-1に近い値に、互いに関連しないとき0に近い値を取る。機能的結合のひとつひとつについて、その強度(相関係数に関連)に重み(係数)を掛け合わせたものを全て足し合わせ、ロジスティック関数に入力して得られた値をうつ病度と呼びます。
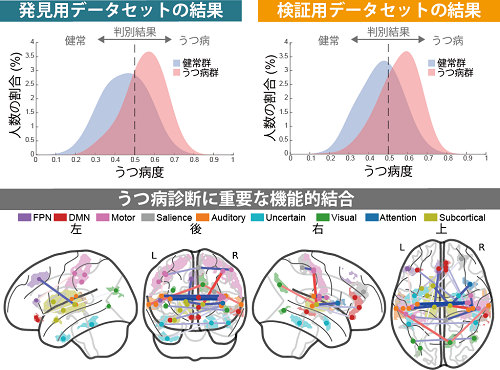
図3: 個人の脳の領域間機能的結合から計算される「うつ病度」により、健常者と大うつ病患者の診断が可能。本研究で開発されたうつ病脳回路マーカーを発見用データセット、検証用データセットに適用した結果。本研究で特定されたうつ病診断に重要な機能的結合の脳内での分布。脳領域の色はその領域の大まかな機能を、線の太さは機能的結合の強さ、線の色は正の相関(赤色)と負の相関(青色)を表す。
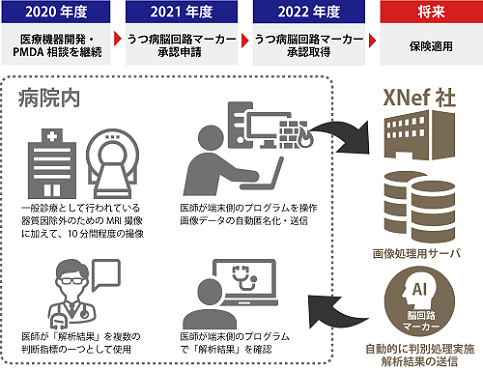
図4: うつ病脳回路マーカーの使用イメージ(将来)
<研究に関すること>
(株)国際電気通信基礎技術研究所(ATR) 経営統括部 企画・広報チーム
TEL: 0774-95-1176
E-mail: pr*atr.jp (注: *は半角@に置き換えてください)
<AMEDの事業に関すること>
国立研究開発法人日本医療研究開発機構 疾患基礎研究事業部 疾患基礎研究課
戦略的国際脳科学研究推進プログラム
TEL: 03-6870-2286
E-mail: brain-i*amed.go.jp (注: *は半角@に置き換えてください)
掲載日 : 2020年12月08日
Copyright © 2003- 広島大学