本研究成果のポイント
- 薬剤耐性がん細胞において、糖転移酵素*1GnT-III*2の発現が著しく抑制されることを発見しました。
- 薬剤耐性細胞にGnT-IIIを発現させるとがん細胞の耐性が消失することを見出しました。
- 本研究は、GnT-IIIによるTNF受容体の糖鎖修飾を介したNF-κB-P糖タンパク質
(P-gp*3)発現制御の仕組みを明らかにしたものです。
- 今回の発見は、糖鎖修飾の制御によるがん化学療法薬剤耐性問題の解決につながることが期待されます。
研究概要
東北医科薬科大学薬学部 細胞制御学教室 顧 建国 教授、薬物治療学教室 蓬田 伸 准教授、広島大学大学院 統合生命科学研究科 中ノ 三弥子 准教授らの研究グループは、糖転移酵素のひとつであるGnT-IIIによるがん細胞の薬剤耐性抑制とその仕組みを明らかにしました。
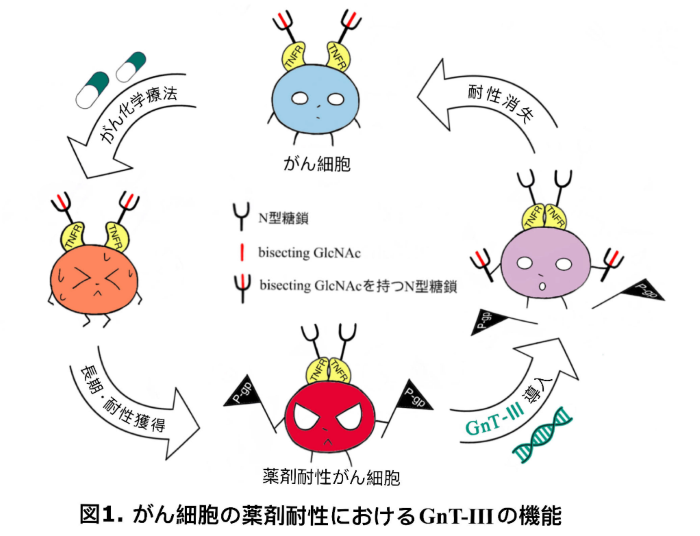
糖タンパク質に付加された糖鎖*4はその品質管理や機能調節など、生体内で重要な役割を果たしています。GnT-IIIは、バイセクト糖鎖(bisecting GlcNAc)を含んだN型糖鎖を作成し、がんの増殖・転移・浸潤に関わることが知られています。本研究では、がん薬剤耐性に深く関わっている薬剤排出の輸送体であるP-gpの発現調節に、糖鎖修飾がスイッチの機能として働く分子機序を解明しました(図1)。本研究は、がん化学療法の難題の一つである薬剤耐性の新な治療法開発につながることが期待されます。本研究成果は、米国の科学雑誌JBCに2023年2月21日付で公開されました。
研究の背景
糖鎖とは、ブドウ糖などの糖が鎖状につながったもので、タンパク質や脂質などに結合した状態で、細胞膜を覆うようにして存在しています。血液型、がんやウイルス感染症など様々な生命活動に深く関与しています。タンパク質につく糖鎖は、細胞の中で糖転移酵素と呼ばれる酵素の働きによって作られます。ヒトには約180種類の糖転移酵素が存在しており、細胞は状況に応じてこれら糖転移酵素の量や活性を調節し、糖鎖の形を作り替えて機能します。
一方、抗がん剤に対する薬剤耐性は、がん化学療法において深刻な問題となっています。がん細胞の薬剤耐性のメカニズムの解明と克服は、がんの化学療法を成功に導くための重要課題です。がん細胞の多剤耐性化に関与するタンパク質として、MDR1遺伝子によりコードされるP-gpが広く認知されています。P-gpはトランスポーターの一種で、ABC輸送体と呼ばれるグループに属して、薬物の体外への排出に関わっています。P-gpががん細胞に発現することで、抗がん剤ががん細胞の外に排出され、細胞内の薬剤濃度を有効濃度以下に下げることにより薬剤抵抗性を示します。
このことからP-gpはがん細胞の薬剤耐性獲得メカニズムのひとつとして注目され、世界中で研究が進んでいますが、その発現誘導に関する分子機序には不明な点が多く残されています。P-gpは10カ所のN型糖鎖修飾部位を持つ膜タンパク質です。これまでの研究では、N型糖鎖修飾がP-gpの細胞表面の発現や安定性に寄与するものの、P-gpの機能にはあまり影響しないと認識されてきました。従って、糖鎖修飾と薬剤耐性の関係に着目した研究は積極的に行われて来ませんでした。
研究内容
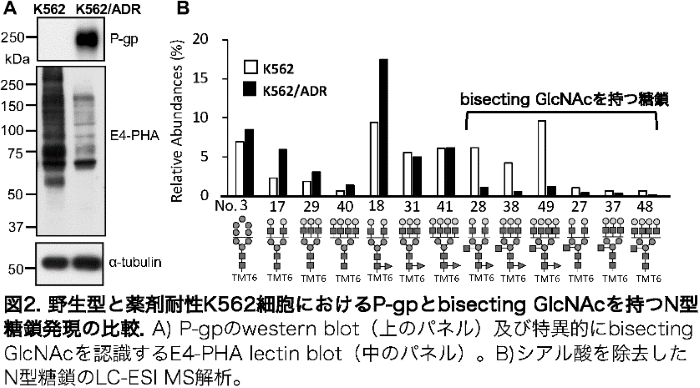
本研究グループは、これまでにGnT-IIIのがん悪性化を抑制する働きがあることを示しました。そこで、特定の糖鎖構造と薬剤耐性の関係を明らかにするため、本研究では、ドキソルビシン(別名アドリアマイシン; ADR)に対する白血病細胞K562薬剤耐性株(K562/ADR)を樹立し、レクチンブロットと質量分析でN型糖鎖構造を解析しました。
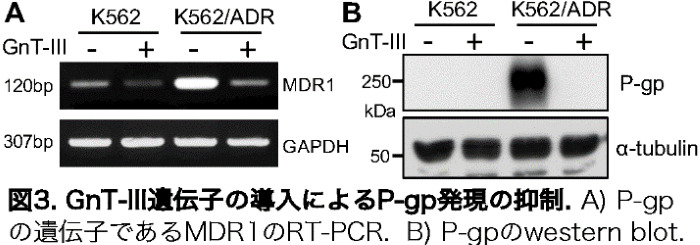
その結果、K562/ADR 細胞ではGnT-IIIの産物であるbisecting GlcNAcを持つN型糖鎖構造が特異的に抑制されていることを見つけました(図2)。驚いたことに、この耐性細胞にGnT-III遺伝子を導入すると、P-gpの遺伝子およびタンパク質の発現が野生株と同程度までに抑制されました(図3)。
これらの結果から、GnT-IIIはP-gp発現のスイッチとして薬剤耐性に非常に重要な役割を担うことが示されました。さらに、そのメカニズムが、GnT-IIIがTNFα*5の受容体であるTNFR2(II型TNF受容体)を特異的に修飾することでTNFR2の多量体形成を制御し、NF-κBシグナル伝達経路を介するP-gpの発現を抑制する分子機序も明らかにしています(図1)。
成果の意義
本研究により、白血病K562細胞とその薬剤耐性細胞を用いた解析では、耐性細胞で高いP-gpの発現に対してGnT-IIIの発現が逆相関し、その耐性細胞に対してGnT-III遺伝子を導入することでP-gpの発現や薬剤の排出能が抑制されることと、その分子機序を明らかにしました。最近、白血病細胞のみならず、他のがん薬剤耐性細胞でもGnT-IIIの発現低下が見られています。加えて、顧らはGnT-IIIががん転移抑制の機能を有することを既に見出しております。
本研究は、糖鎖修飾によるがん細胞の薬剤耐性と機能制御という視点から、新規のがん治療法の開発に貢献すると期待されます。本研究グループでは、糖鎖修飾の役割について着目したがん化学療法における薬剤耐性の克服に向けた研究を、さらに進める予定です。
本研究は、JSPS科研費19H03184, 21K06547, 22K06615, 22K19443および共同利用・共同研究拠点として文部科学大臣認定を受けた糖鎖生命科学連携ネットワーク型拠点
(J-GlycoNet)における戦略的融合研究として、ヒューマングライコームプロジェクト(Human Glycome Atlas Project (HGA))を推進する共同研究として実施されました。
用語説明
*1. 糖転移酵素:糖鎖合成に関与する酵素。ヒトでは約180種類存在することが知られている。主に、細胞中のゴルジ体と呼ばれる小器官に存在している。
*2. GnT-III:N-acetylglucosaminyltransferase IIIの略で糖転移酵素の一つである。糖タンパク質上のN型糖鎖にbisecting GlcNAcを持つ構造を作る。N型糖鎖は複雑な分岐構造を持つがbisecting GlcNAcを作ると、他の糖転移酵素による分岐構造を作り難くなるため、N型糖鎖の高分岐化が抑制される。
*3. P-gp: P糖タンパク質の略でABC輸送体(ATP-binding cassette transporters)の一種であり、細胞膜上に存在して薬物の体外への排出に関わっている。P-gp以外にMDR1(Multiple drug resistance 1)やABCB1(ATP-binding Cassette Sub-family B Member 1)とも呼ばれる。
*4. 糖鎖:グルコース(ブドウ糖)などの糖が鎖状につながったもので、遊離の状態で存在するものもあれば、タンパク質や脂質に結合した状態のものもある。N型糖鎖はタンパク質のアスパラギン残基(N)に付加される糖鎖で,最も普遍的な翻訳後修飾の1 つである。
*5. TNFα: 腫瘍壊死因子(Tumor Necrosis Factor)と呼ばれるサイトカインの一つである。TNFαはNF-κBの活性化因子である。
原著論文
- タイトル:Expression of GnT-III decreases chemoresistance via negatively regulating
P-glycoprotein expression: Involvement of the TNFR2-NF-κB signaling pathway
- 著者:Wanli Song,‡ Caixia Liang,‡ Yuhan Sun, ‡ Sayaka Morii, § Shin Yomogida, ‡ Tomoya Isaji,‡ Tomohiko Fukuda,‡ Qinglei Hang, ‡ Akiyoshi Hara, ‡ Miyako Nakano,§ and Jianguo Gu‡
- 著者所属:‡東北医科薬科大学薬学研究科; §広島大学大学院統合生命科学研究科
- DOI: https://doi.org/10.1016/j.jbc.2023.103051
【お問い合わせ先】
<研究に関すること>
東北医科薬科大学 薬学研究科細胞制御学教室
教授 顧 建国(グ チェゴ)
TEL:022-727-0216 (直通)
E-mail: jgu*tohoku-mpu.ac.jp
広島大学大学院 統合生命科学研究科
生物工学プログラム
准教授 中ノ 三弥子(ナカノ ミヤコ)
TEL:082-424-4539 (直通)
E-mail: minakano*hiroshima-u.ac.jp
<取材に関すること>
学校法人東北医科薬科大学 企画部広報室
TEL:022-727-0358(直通)
E-mail:koho*tohoku-mpu.ac.jp
大学HP:https://www.tohoku-mpu.ac.jp/
広島大学 広報室
TEL:082-424-3749(直通)
E-mail:koho*office.hiroshima-u.ac.jp
大学HP:https://www.hiroshima-u.ac.jp/
(注: *は半角@に置き換えてください)

 Home
Home