発表のポイント
生物の組織や器官は多くの細胞から成り立つ秩序と機能を持った社会性のある集団です。このような多細胞集団が秩序を持って維持されていくためには、その構成因子である細胞は個々にバラバラに振る舞うのではなく、お互い同士が何らかのコミュニケーションを取り合っていることが大事だと考えられます。細胞相互のコミュニケーションには、個々の細胞が周囲に向けて放出する液性のシグナル分子が関わることが予想されてきましたが、細胞同士が互いにそのような液性のシグナル分子を出し合うことが多細胞集団の機能維持に本当に必要なのか、必要であるとすればどのような役割を果たすのかという点は未だにほとんど明らかになっていませんでした。基礎生物学研究所/生命創成探究センターの畠山宙大大学院生、高田慎治教授らを中心とした研究グループは広島大学/生命創成探究センターの斉藤稔准教授らと共同で、マウスの胚の発生をモデルにして、この問題に取り組みました。
脊椎動物の胴体や尾は、頭側から尾の先端方向に向けて胚が徐々に伸長していくことによって作られていきます。その際、胴体や尾の様々な組織の細胞は胚の最も後端に存在する前駆細胞から作られます。この前駆細胞の集団は、液性のシグナル分子の一つであるWnt3aを互いに放出し合っており、Wnt3aを欠落した胚では、胚の伸長過程の途中で前駆細胞が完全に枯渇し、前肢より後ろの体の組織が全くできません。本研究では、個々の細胞が作り出すWnt3aが、その細胞自身には作用するものの、周囲の細胞には作用しないようにしたマウス胚を人為的に作出し、細胞相互のWnt3aのやりとりが前駆細胞集団の機能や維持にどのように働いているのかを検討しました。この胚では、前駆細胞の数が減少するものの、一部の前駆細胞は維持され、その結果尻尾が細くなっていました。前駆細胞を詳細に調べたところ、正常な胚においても、分化した細胞を生み出す能力には、各々の前駆細胞ごとにある程度のバラツキがありましたが、本研究で作出した胚においては、その格差が拡大していました。またこの胚は、前駆細胞の維持を抑制する周囲からの刺激に対して、極めて脆弱であることもわかりました。これらの結果から、胚の後端の前駆細胞集団においては、Wnt3aによる細胞相互のコミュニケーションは、細胞間の格差の拡大を是正し、細胞社会をより頑強にするものと考えられます。
本研究成果は、2023年4月6日に国際学術誌『Nature Communications』に掲載されました。
研究の背景
脊椎動物の胚では、体幹部(胴体と尾)の発生は前方から後方に向かって徐々に伸長しながら進んで行きます(図1)。この伸長過程では、胚の最後端にある尾芽に存在する前駆細胞から生じた細胞が体幹部の様々な組織を作る細胞へと分化します。すなわち、尾芽の前駆細胞が維持されている間は胚の伸長が続き、それが枯渇することによって胚の伸長は停止します。尾芽にはWntやFGFなどの液性のシグナル分子が発現し、前駆細胞の維持に関わることが既に示されています。これらの液性シグナル分子を受容した細胞では、細胞内のシグナル伝達経路が活性化され、その下流で転写制御因子であるBrachyury(別名T。以下、Braと呼ぶ)遺伝子の発現が誘導されます(図2)。マウスの尾芽ではBraはWnt3aの発現を誘導することから、Wnt3aとBraの間にはお互いの発現を誘導し合うという正のフィードバックループが形成されることになります。その結果、個々の前駆細胞は自己が産生するWntによってこの正のフィードバックループを回し続け、前駆細胞としての機能を維持できるものと考えられます。このように液性シグナル分子が産生細胞自身に働きかける作用をオートクラインと呼び、それに対して周囲の細胞に働きかける作用をパラクラインと呼びますが、尾芽の前駆細胞はWntのオートクライン作用で十分に維持できるのでしょうか、それともパラクライン作用が何らかの役割を果たしているのでしょうか。このような点については、適切な研究手法がないことなどから未解決のままでした。
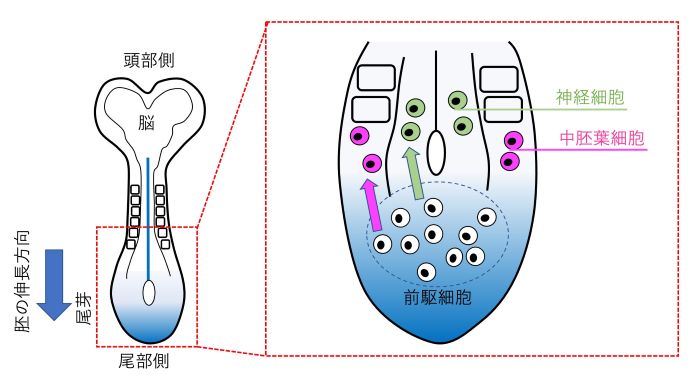
図1 脊椎動物の胚は尾芽に存在する前駆細胞から作られる
左に示すのは、発生初期のマウス胚を背中側から見た模式図です。青色で示した胚の最後端は尾芽(発生初期には、エピブラストとも呼ばれます)と呼ばれ、神経細胞や中胚葉細胞(筋肉や骨などのもとになる細胞)といった胴体と尾を形作る全ての細胞は尾芽に存在する前駆細胞から生み出されます。
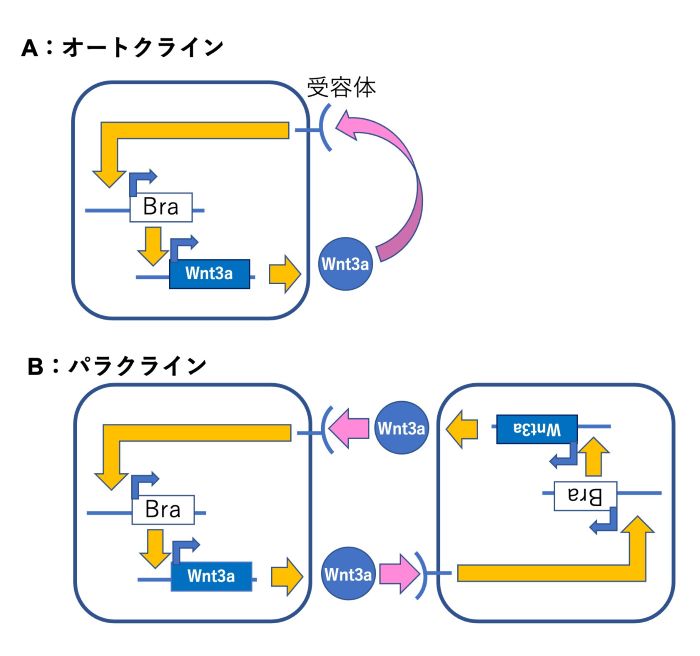
図2 分泌シグナルWntの作用機構
尾芽の各細胞は、Wnt3aを産生すると同時にそれを受容します。細胞がWnt3aを受容すると、転写制御因子であるBraの産生が亢進し、さらに、BraはWnt3aの産生を亢進します。すなわち、Wnt3aとBraはお互いの産生を正に制御し合う関係にあり、このような制御を正のフィードバックと呼びます。したがって、一旦Wnt3aの発現量が増加し始めると、Braの産生量も増加し、その結果さらにWnt3aの産生量も増えるという、いわゆる拡大再生産が起きます。一方、一旦Wnt3aの産生量が減少方向に転ずると、その結果BraとWnt3aの産生量はどんどん減少し続けるという、縮小再生産が起きます。このようなWnt3aとBraの正のフィードバック制御は、細胞が自己の産生したWnt3aを受容する場合にも、また近隣の細胞が産生したWnt3aを受容した場合にも起きます。前者のような自己に対して働きかける作用をオートクラインと呼び、近隣の細胞に対して働きかける場合をパラクラインと呼びます。本研究では、Wnt3aのパラクライン機能だけを欠落させたマウス胚を人為的に作出し、この機能が尾芽の前駆細胞集団の機能維持に及ぼす影響を検討しました。
研究成果の概要
本研究では、この問題を検討するために、オートクライン機能を有するもののパラクライン機能を失った改変型Wnt3a遺伝子を作成し、それを胚が本来持つWnt3a遺伝子(以下、内在性Wnt3aと呼ぶ)と置き換えたマウス胚を作成しました。具体的にはWnt3aのC末端に受容体である7回膜貫通タンパク質のFrizzled5を結合させた融合タンパク質をコードする遺伝子を内在性のWnt3aと置換したノックインマウスを作成しました。この融合タンパク質は、十分なオートクライン作用を有するものの、周囲の細胞に対して働きかける機能、すなわちパラクライン作用を完全に失っていました。興味深いことに、このノックインマウスにおいては体軸の伸長過程の途中から尾芽の前駆細胞の数が急激に低下するものの、少数の前駆細胞は体軸伸長期を通じて維持され続け、結果として後肢より後方では尾が細く貧弱な構造になっていました(図3)。尾芽の前駆細胞集団の個々の細胞におけるWntシグナル活性をシングルセルレベルの空間分解能を持つレポーターマウスを用いて解析した結果、ノックインマウスでは正常胚に比べて細胞間でのWntシグナル活性のばらつきが大きくなっていました。すなわち、正常な胚では、細胞相互のWnt3aのやりとりによって細胞間の格差の拡大が緩和されていることがわかりました(図4)。
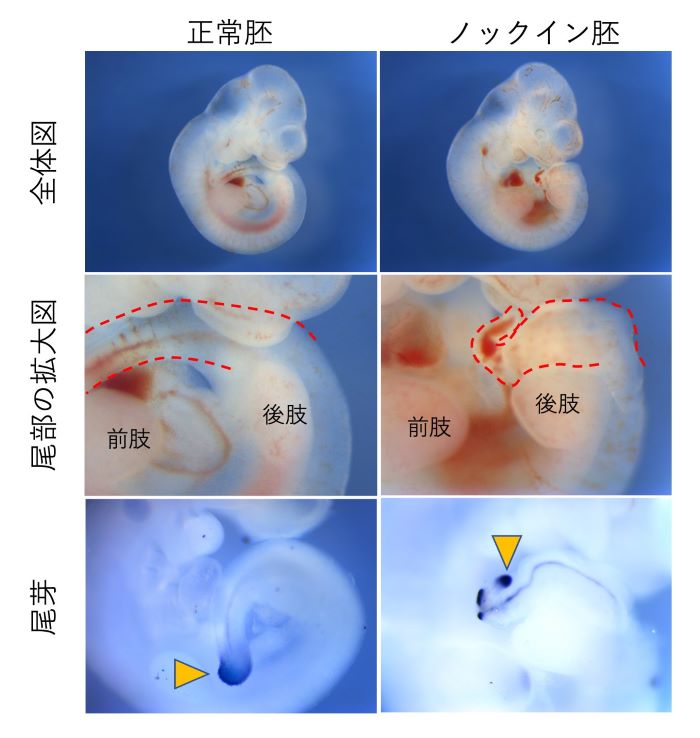
図3 Wnt3aのパラクライン機能を欠落させたマウス胚
Wnt3aのパラクライン機能を欠落させたマウス胚(ノックイン胚)の形態異常を正常胚と比較して示しました。受精後10日の胚の様子をお示しします。ノックイン胚は後肢より前方の形態には異常は観察されませんでしたが、後肢より後方では尾が細く短くなっていました(中段:尾部の拡大図)。一方、尾芽の前駆細胞(下段:矢尻で示した青色部分)は数が減少するものの、胚が後方に伸長を続ける間は維持されていました。したがって、ノックイン胚では、尾芽に存在している前駆細胞集団が数こそ減るものの正常な期間維持され続けることがわかりました。
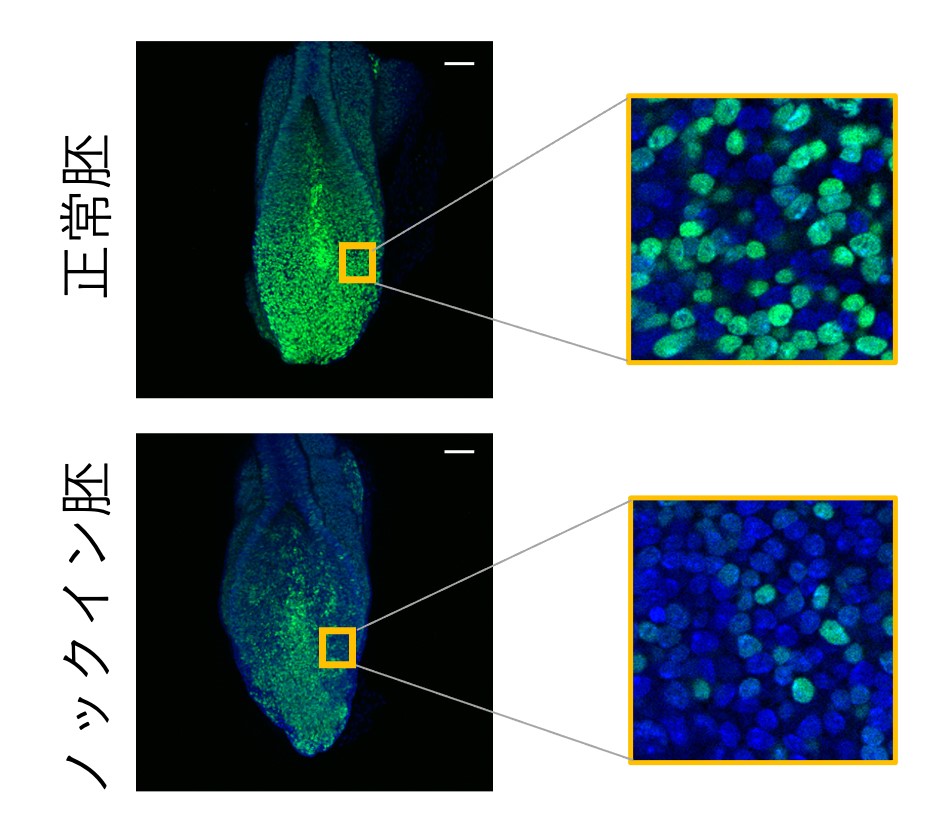
図4 Wnt3aのパラクライン機能を欠落させたマウス胚の前駆細胞
ノックイン胚の前駆細胞の様子をさらに詳細に調べました。前駆細胞が維持されるためにはWnt3aやBraを産生し続けることが必要であることが既に先行研究より明らかにされています。そこで、細胞一つ一つがこれらの遺伝子をどの程度産生しているのかをノックイン胚と正常胚で比較してみました。具体的には、Wntの受容量に応じて緑色蛍光タンパク質(GFP)の蛍光強度が高まる遺伝子を用いて比較を行いました。その結果、胎生8日のノックイン胚の尾芽では、GFP陽性の前駆細胞の数が減少していましたが、GFP強度が高く保たれた前駆細胞が点在して存在していました。さらに、ノックイン胚では、近隣の細胞との間でのGFP強度のばらつきが正常胚より有意に高くなっていました。このことから、Wnt3aのパラクライン機能を欠落させたノックイン胚では、前駆細胞集団内におけるばらつきが亢進している、すなわち、Wnt3aのパラクライン機能は前駆細胞集団内のばらつき(格差)の是正に寄与しているものと考えられました。
一方、レチノイン酸(RA)は前駆細胞集団の外部で産生され、Wnt3aとBraの正のフィードバック制御にブレーキをかけます。すなわち、レチノイン酸の濃度が高まっていくと、正のフィードバック制御を介したWnt3aやBraの量の増加に徐々に歯止めがかかるようになります。その結果、最終的には前駆細胞のWnt3aとBraがなくなり、その時点で胚の尾部方向への伸長が止まります。そこでレチノイン酸に対する前駆細胞の抵抗性を検討したところ、ノックインマウスの前駆細胞集団は、レチノイン酸への抵抗性が低く、低濃度のレチノイン酸に暴露されただけでも、体軸伸長が著しく阻害されることが明らかになりました。したがって、Wnt3aの相互交換によって前駆細胞集団は外部からの抑制的なストレスに対してより頑強になるものと考えられました。さらに、これらの実験結果をもとにして作られた数理モデル(図5)からもWntの相互交換が前駆細胞集団の均一性を拡大させ、抑制的な外部ストレスに対する頑強性を高めることが支持されました。以上の研究成果は、細胞集団内部でのシグナルの相互交換が、集団の均一性並びに頑強性を高める役割を担う事を示しており(図6)、細胞集団内部におけるシグナルの相互伝達の意義を実験的に初めて明らかにしたものとして高く評価できるものです。
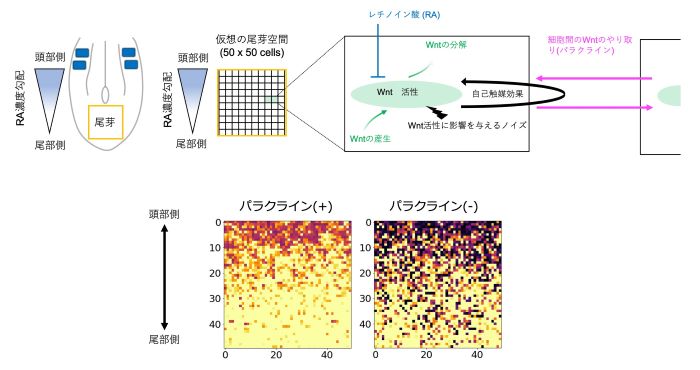
図5 数理モデルによるWntパラクライン機能の検証
ノックイン胚で観察されたような前駆細胞のばらつきが、我々が解釈したようにWnt3aパラクライン機能の欠落によって生み出されていることを検証するために、数理モデルを作成し検討しました。具体的には、上段に示すように、擬似前駆細胞集団を想定し、Wntの合成と分解、Wnt-Bra間の正のフィードバックによる制御、レチノイン酸によるフィードバック制御への阻害効果、パラクライン機能の有無等を想定し、数理シミュレーションを行いました(数理モデルの概要を上段に示します)。その結果、パラクライン機能の有無によって明らかにWntの受容量(図4のGFP強度に相当する量)のばらつきに差が生まれたことから、モデルの妥当性が示唆されました(下段)。
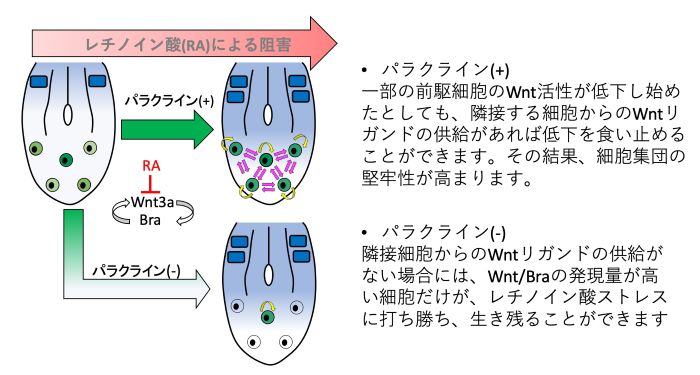
図6 本研究の成果をもとに提唱したWntパラクライン機能を説明するモデル
本研究の成果をもとに、Wntパラクライン機能による尾芽の前駆細胞集団の制御機構を模式的に示しました。ここに示すように、近隣組織から分泌されるレチノイン酸によってWnt/Braの産生は抑制されますが、仮に一部の前駆細胞のWnt活性が低下し始めたとしても、パラクライン機能によって隣接する細胞から供給されるWntがあればこの低下を食い止めることができます。その結果、細胞集団全体の均一性が高まるともに、レチノイン酸のような外部ストレスに対する堅牢性が高まります。
今後の展開
本研究が明らかにした液性因子による細胞集団の維持は、これまで理解が進んでいなかった細胞の社会性の維持機構を分子レベルで理解する上での糸口となるものです。今後、Wntを中心とした制御機構の全貌が分かることによって、組織や器官を形成する上で重要な細胞の社会性を生み出す仕組みが理解できるようになると考えられます。また、そのような仕組みは、多細胞が集合して機能的な組織や器官を作っていく上で不可欠なものです。本研究の成果が契機となって、組織や器官をより効率的に再生する方法論が生まれることが期待できます。
掲載論文
- 雑誌名:Nature Communications
- 論文名:Intercellular exchange of Wnt ligands reduces cell population heterogeneity during embryogenesis
(細胞間におけるWntリガンドの交換は胚発生過程における細胞集団の不均一性を減少させる)
- 著者名:Yudai Hatakeyama, Nen Saito, Yusuke Mii, Ritsuko Takada, Takuma Shinozuka, Tatsuya Takemoto, Naoki Honda, Shinji Takada
(畠山宙大,斉藤稔,三井優輔,高田律子,篠塚琢磨,竹本龍也,本田直樹,高田慎治)
- 掲載日:2023年4月6日にオンライン版に掲載
- DOI: 10.1038/s41467-023-37350-x
研究グループ
基礎生物学研究所/生命創成探究センターの畠山宙大大学院生、高田慎治教授らを中心として、徳島大学の竹本龍也教授、広島大学の斎藤稔准教授(生命創成探究センター准教授を兼任)、本田直樹教授(生命創成探究センター客員教授を兼任)らとの共同研究として実施されました。
研究サポート
本研究は、以下のサポートを受けて実施されました。
科学研究費補助金:18H02454、21H02498、24111002、17H05782、19H04797、22H05642、21H05793
自然科学研究機構分野融合型共同研究事業、ExCELLS連携研究(21-102)
【本件内容の問い合わせ先】
【研究内容全般に関すること】
基礎生物学研究所/生命創成探究センター 教授
高田 慎治(たかだ しんじ)
TEL:0564-59-5241
E-mail:stakada*nibb.ac.jp
【数理モデルに関すること】
広島大学 大学院統合生命科学研究科 准教授
(生命創成探究センターを兼任)
斉藤 稔(さいとう ねん)
E-mail:nensaito*hiroshima-u.ac.jp
【報道担当】
自然科学研究機構 基礎生物学研究所 広報室
TEL: 0564-55-7628
FAX: 0564-55-7597
E-mail: press*nibb.ac.jp
自然科学研究機構 生命創成探究センター 研究戦略室
TEL: 0564-59-5203
FAX: 0564-59-5202
E-mail: press*excells.orion.ac.jp
広島大学 広報室
TEL: 082-424-3749
FAX: 082-424-6040
E-mail: koho*office.hioshima-u.ac.jp
(注: *は半角@に置き換えてください)

 Home
Home