大学院統合生命科学研究科 堀内 浩幸
Tel:082-424-7970 FAX:082-424-7970
E-mail:hhori10*hiroshima-u.ac.jp
(注: *は半角@に置き換えてください)
ニワトリは鶏肉や鶏卵といった食料として、またワクチンや医薬品を作る「生物工場(※4)」としても重要な家禽です。さらに、発生学などのモデル生物として学術的にも重要であり、ニワトリでのゲノム編集技術の適用は、基礎研究から産業発展に大きく貢献することが期待されています。ニワトリでは、精子や卵へ分化する始原生殖細胞(PGC)を介した方法でゲノム編集ニワトリを作出します。ゲノム編集ニワトリを作出する上で、ニワトリPGCへの遺伝子導入は欠かすことのできない操作ですが、ニワトリPGCへの遺伝子導入効率は非常に低いことが知られています。効率よくゲノム編集ニワトリを作出するためには、ニワトリPGCへの高効率な遺伝子導入が求められます。
広島大学大学院統合生命科学研究科の堀内浩幸教授らの研究グループは、遺伝子導入時の培地条件に着目し、リポフェクション(※5)による遺伝子導入効率の向上を図りました。その結果、これまで使用していた培地に含まれるヘパリン(※6)がリポフェクションによる遺伝子導入を著しく阻害していたことが明らかとなりました。また、遺伝子導入試薬やその他の培地条件についても検討したところ、これまで報告されていた方法よりも高効率な遺伝子導入条件を見出すことに成功しました。さらに、この手法を用いてCRISPR/Cas9によるゲノム編集を行なったところ、ゲノム編集された細胞を確認することができ、本手法がゲノム編集にも十分に利用できることを示しました。
堀内教授らの研究グループでは、先にオボムコイドフリー鶏卵の作出に成功していますが、開発までに10年という長い年月を要しました。今回の発見は、この研究開発期間を大幅に短縮することができる技術です。
今回得られた手法を用いることで、ゲノム編集されたニワトリPGCを取得しやすくなり、今後、ゲノム編集ニワトリを用いた基礎研究や産業応用の発展が期待されます。
なお、本研究成果は2023年8月10日にWiley社が発刊する専門誌「Biotechnology journal」に電子版として公開されました。
ニワトリは食・産業・学術など様々な分野で利用されている家禽であり、ニワトリでの遺伝子改変はこれらの分野でその有用性が期待されています。近年では、ゲノム編集技術を用いて低アレルゲン性鶏卵の開発や医薬品タンパク質を含有する鶏卵の開発が報告されるようになり、ゲノム編集ニワトリの産業利用の可能性が現実味を帯びてきました。
ニワトリでは、精子や卵へ分化する始原生殖細胞(PGC)へゲノム編集を施すことで目的の変異を有するゲノム編集ニワトリを作出します。ニワトリPGCは長期培養が可能であり、in vitroにて遺伝子改変やスクリーニングを行うことができます。培養PGCでゲノム編集を行うためにはCRISPR/Cas9などゲノム編集ツールを発現する遺伝子を細胞へ効率よく導入する必要があります。しかし、培養PGCは遺伝子導入効率が低く、ゲノム編集ニワトリを作出する上で障壁となっていました。そこで、本研究ではニワトリPGCで効率的にゲノム編集を行うために、遺伝子導入方法の改善を図りました。
本研究では、ニワトリPGCでよく用いられるリポフェクションによる遺伝子導入の効率の改善に取り組みました。培地添加物であるヘパリンに着目して遺伝子導入効率を評価したところ、培地中のヘパリンがリポフェクションによる遺伝子導入効率を顕著に低下させることが明らかとなりました。また、リポフェクション試薬も検討することで、高効率な遺伝子導入を達成することができました(図1)。さらに、この手法を用いてCRISPR/Cas9を介したゲノム編集効率(ノックアウト効率およびノックイン効率)を評価したところ、これまで報告のあった方法に比べて効率よくゲノム編集されたPGCを取得できることが示唆されました(図2)。
本研究で得られたニワトリPGCへの高効率な遺伝子導入方法を利用することで、今後様々な遺伝子改変ニワトリの作出効率が向上することが期待できます。また、より高精度な遺伝子改変技術や改変されたPGCのみを効率よく回収する方法の開発が求められます。

図1. ニワトリPGCにおける遺伝子導入効率の検討
(A)培地中ヘパリン濃度と遺伝子導入効率、(B)従来に比べ高効率な遺伝子導入方法nituiteha
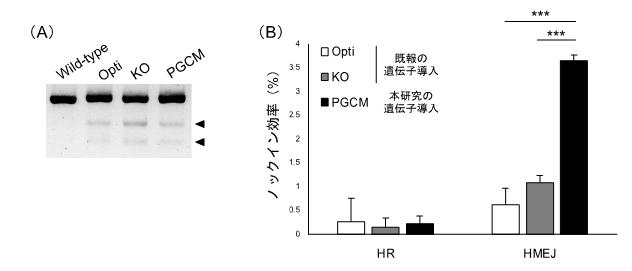
図2. 最適化リポフェクションによるニワトリPGCでのゲノム編集
(A)遺伝子ノックアウトの評価:矢頭部分が遺伝子のノックアウトの変異を表す
(B)遺伝子ノックインの評価:正確な外来遺伝子の導入方法として知られているHRとHMEJを比較したところ、本研究で開発した培地は、HMEJで既存の培地よりも3倍以上の遺伝子導入効率を示した
本研究は、日本学術振興会(JSPS)科学研究費助成事業(19H03107と19K22286)ならびに国立研究開発法人科学技術振興機構(JST)のCOI-NEXT(JPMJPF 2010)の支援により行われ、得られた成果である。
※1 始原生殖細胞(PGC):精子や卵になる細胞
※2 CRISPR/Cas9:細菌が持つ獲得免疫機構に関わるシステムを利用したゲノム編集ツール。標的とするDNAを認識するsingle guide RNAとDNA切断酵素Cas9で構成される。
※3 ゲノム編集:細胞の持つゲノム修復機構を利用した遺伝子改変技術。CRISPR/Cas9などを利用して標的ゲノムDNAに二本鎖切断を誘導することで、狙った部分を改変することができる。
※4 生物工場:生物を利用して医薬品のような有用なタンパク質を生産する方法
※5 リポフェクション:細胞に遺伝子を導入するための方法の1つ。
※6 ヘパリン:多糖の1つ。細胞培養においては増殖を補助する働きが知られている。
大学院統合生命科学研究科 堀内 浩幸
Tel:082-424-7970 FAX:082-424-7970
E-mail:hhori10*hiroshima-u.ac.jp
(注: *は半角@に置き換えてください)
掲載日 : 2023年09月21日
Copyright © 2003- 広島大学