広島大学 広報室
Tel:082-424-4383
E-mail:koho@office.hiroshima-u.ac.jp
概要
京都大学iPS 細胞研究所(CiRA)の井上治久教授、徳島大学病院 脳神経内科 和泉唯信教授、藤田浩司講師、京都大学医学部附属病院 脳神経内科 髙橋良輔前教授、江川斉宏前院内講師、北里大学病院 脳神経内科 西山和利教授、永井真貴子診療准教授、鳥取大学医学部附属病院 脳神経内科花島律子教授、渡辺保裕准教授、奈良県立医科大学附属病院 脳神経内科 杉江和馬教授、東邦大学医療センター大森病院 脳神経内科 狩野修教授および広島大学病院 脳神経内科 丸山博文教授らの研究チームは、「筋萎縮性側索硬化症(ALS)患者さんを対象としたボスチニブ第2 相試験」(iDReAM試験:iPSC-based Drug Repurposing for ALS Medicine Study)注1 を行い、ボスチニブの有効性と安全性を評価しました。本治験は、多施設共同 ALS 患者さんのレジストリであるJapaneseConsortium for Amyotrophic Lateral Sclerosis research(JaCALS)(愛知医科大学 祖父江元学長、中央事務局 熱田直樹准教授)と連携して実施しました。また、秋田大学大学院医学系研究科髙橋直人教授との共同研究で薬物動態解析を実施しました。
同チームはこれまでALS 患者さんのiPS 細胞を用いて、病態再現と薬剤スクリーニングを実施し、慢性骨髄性白血病の治療薬であるボスチニブが強い抗ALS 病態作用を有することを見出し、この薬をALS 治療薬として開発するために、医師主導治験を実施してきました。2019 年から2021 年まで実施した第1 相試験では、ボスチニブにALS 特有の有害事象注2 は認められなかったこと、ボスチニブの投与期間に一部の患者さんでALS の進行の抑制が認められたこと、その目印となる可能性のある指標があったことが明らかになりました。
2022 年より、第1 相試験よりもボスチニブの投与期間を長くし、ご参加される患者さんの数を増やして第2 相試験を行いました。その結果、過去のALS 試験の結果に基づき事前に設定した有効性に関する基準(主要評価項目、副次評価項目)において、主要評価項目2 つを達成し、副次評価項目の2 つのうち1 つは満たさなかったものの、1 つは達成しました。以上より、ボスチニブの有効性が示唆されました。また、安全性に関してはALS 特有の有害事象は認められませんでした。
今後、iPS 創薬注3 による第1 相試験及び第2 相試験の結果に基づいて、次の計画を検討していきます。
研究の背景と概要
筋萎縮性側索硬化症(ALS)は、運動神経細胞が変性して筋萎縮と筋力低下を来す進行性の疾患で、経過に個人差はあるものの、人工呼吸器を使用されなければ、発症から数年で落命される疾患です。ALS の進行を緩和する既存薬はありますが、いまだALS の進行を停止する根本的治療は確立されていません。
これまで、研究チームは、ALS 患者さん由来のiPS 細胞から作製した運動神経細胞を用いて、ALSの病態を再現できることを見出し( 参照: CiRA プレスリリース2012 年8 月1 日https://www.cira.kyoto-u.ac.jp/j/research/finding/120801-183739.html)、さらに、ALS の病態の中核である運動神経細胞の細胞死と異常タンパク質の蓄積を抑えることができる化合物のスクリーニングを行うiMN システム注4 を構築しました(参照:CiRA プレスリリース2017 年5 月25 日https://www.cira.kyoto-u.ac.jp/j/pressrelease/news/170525-030000.html)。このシステムを用いて、既に他の疾患で治療薬として用いられている物質を含むさまざまな種類の化合物をスクリーニングした結果、強い抗ALS 病態効果を有するボスチニブを同定したことを報告しました。ボスチニブ(販売名:ボシュリフ®錠)は、慢性骨髄性白血病の治療薬として製造販売承認されている薬剤です。ALS はボスチニブの適応症として日本および世界各国で承認されておらず、ALS に対する有効性、安全性および用法用量は確立されていません。そのため、ボスチニブは現時点でALS の治療薬として使用できる状況にありません。
研究チームは、2019 年から2021 年まで、「筋萎縮性側索硬化症(ALS)患者さんを対象としたボスチニブ第1 相試験」(iDReAM 試験)を行い(参照:CiRA プレスリリース2019 年4 月23 日https://www.cira.kyoto-u.ac.jp/j/pressrelease/news/190423-100001.html)、ALS 患者さんにおけるボスチニブの安全性と忍容性を評価し、探索的に有効性評価を行いました。その結果、参加された患者さんの人数に限りはあるものの、ボスチニブにALS 特有の有害事象は認められなかったこと、ボスチニブの投与期間に一部の患者さんでALS の進行の抑制が認められたこと、その目印となる可能性のある指標があったことを見出しました( https://www.cira.kyotou.ac.jp/j/pressrelease/news/211001-000000.html)。
2022 年から第2 相試験として、約25 名のALS 患者さんにおいて、ボスチニブの24 週間投与時の有効性および安全性を評価することを目的とした多施設共同の非盲検試験を開始しました。
近年、プラセボと呼ばれる偽薬を対照とした比較試験の実施の代わりに、実際の医療環境下で取得されたリアルワールドデータを外部対照として活用することが進められつつあります(薬生薬審発0323 第1号)。本試験では、対照としてプラセボは用いず、過去のALS 試験の結果に基づき有効性に関する基準を事前に設定するとともに、探索的に多施設共同ALS 患者さんのレジストリ(JaCALS)に登録されている患者さんの自然歴のデータとの比較を行いました。
研究の結果
ALS 患者さん26 名が試験に参加され、ボスチニブ1 日量200mg もしくは300mg を投与されました。主要評価項目では、ALS の承認薬であるエダラボンの臨床試験(MCI186-19)のプラセボ群に基づく基準に比べて、運動機能障害の強さを示すALSFRS-R 注5 のスコアの低下が抑制されていることが示されました。副次評価項目では、有効性に関して事前に定めた基準を達成した項目と達成に至らなかった項目がありました。
安全性評価では、ALS 特有の有害事象はありませんでしたが、下痢、肝機能障害などが認められました。これらの有害事象は、治験実施計画書に規定した基準に基づき、ボスチニブの用法用量の調整や支持療法による管理が必要な場合がありました。
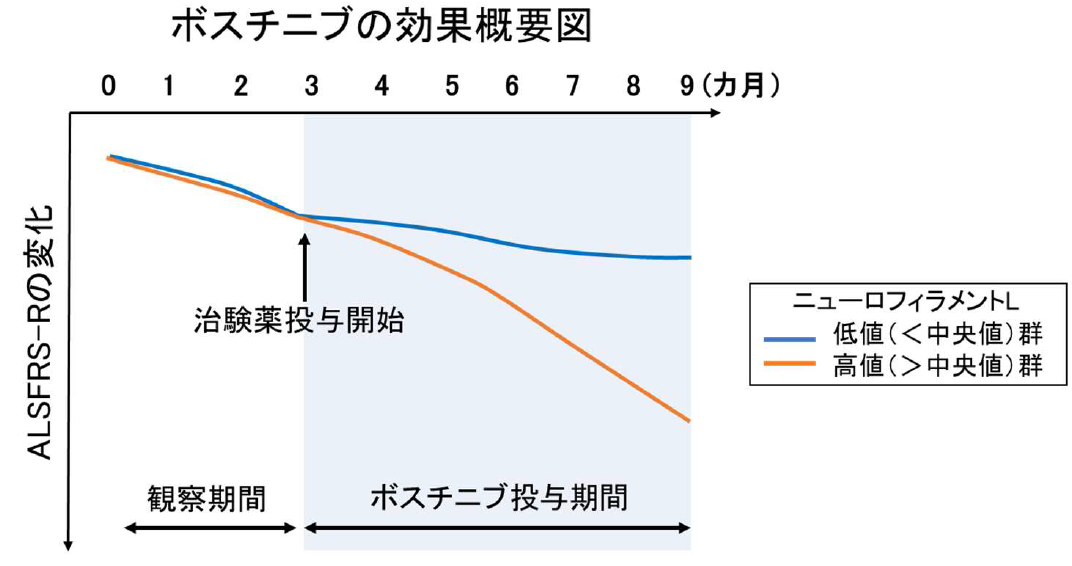
探索的評価として実施したレジストリ(JaCALS)データとの比較において、ボスチニブの有効性が示唆されました。また、ALS のバイオマーカーである血漿中ニューロフィラメントL(NFL)注6 の値は、発症後は平均すると一定の値で推移することが過去のレビュー論文(多くの論文の結果をまとめた論文)注7 で報告されています。本治験においては、血漿中NFL の値を観察期間(ボスチニブ投与開始前)と治験薬投与期間で測定したところ、治験薬投与後、患者さんのNFL の平均値が治験薬投与前の平均値よりも低下していました。しかし、観察期間にNFL の自然低下を示した患者さんもおられたことから,このNFL の値の推移については今後の解析により慎重に検討いたします。
さらに、ボスチニブの24 週間の投与において、探索的に行った評価において、第1 相試験の結果と同様に以下のように一部の患者さんでALS の進行の抑制が認められる結果が得られました。
まとめ
2019 年から2021 年まで実施した第1相試験の結果にもとづき、2022 年から開始した第2 相試験は、患者さんの数を約25 名に増やして、ボスチニブを24 週間投与し、その有効性と安全性の評価を行う医師主導治験として実施しました。結果として、過去のALS 試験の結果に基づき事前に設定した有効性に関する基準において、主要評価項目2 つを達成し、副次評価項目の2 つのうち1 つは満たさなかったものの、1 つは達成しました。以上より、ボスチニブの有効性が示唆されました。また、安全性に関してはALS 特有の有害事象は認められませんでした。
本研究の支援
本研究は、下記機関より資金的支援を受けて実施されました。
・日本医療研究開発機構(AMED)創薬事業部(規制科学推進課)臨床研究・治験推進研究事業患者のニーズに応える医薬品開発に資する臨床研究・治験の推進 疾患登録システム(患者レジストリ)を活用した医薬品開発を目指す臨床研究・医師主導治験の推進 の研究課題「患者レジストリを活用した筋萎縮性側索硬化症治療薬開発のための第2 相医師主導治験」
・iPS 細胞研究基金
その他の支援として、本第2 相試験は、ファイザー株式会社と京都大学の共同研究契約に基づき、ファイザー株式会社から治験薬の提供、安全性情報提供、治験デザインおよび治験実施管理等の助言・サポートを受けて実施しました。
用語説明
注1)筋萎縮性側索硬化症(ALS)患者さんを対象としたボスチニブ第2 相試験
筋萎縮性側索硬化症患者さんを対象としたボスチニブの医師主導治験。
https://www.cira.kyoto-u.ac.jp/j/pressrelease/news/220415-130000.html
注2)有害事象
薬を投与された患者さんに生じたあらゆる好ましくない徴候、症状、または病気。
注3)iPS 創薬
iPS 細胞を用いた治療薬研究。iPS 細胞は患者さんの遺伝子情報を有しているため、患者さんの病気の特徴を再現した細胞で化合物などの効果を調べることができ、患者さんの病態にあった薬を抽出可能である利点がある。
注4)iMN システム
iPS 細胞に3 つの転写因子Lhx3, Ngn2, Isl1 を導入し、迅速に運動神経細胞を作製する方法。iPS細胞から、短期間に再現性良く大量の運動神経細胞を作製でき、化合物などのスクリーニング研究に適している。
https://www.cira.kyoto-u.ac.jp/j/pressrelease/news/170525-030000.html
https://www.cira.kyoto-u.ac.jp/j/pressrelease/news/170202-150000.html
注5)ALSFRS-R
ALS 機能評価スケール改訂版(ALS functional rating scale–revised)。
注6)ニューロフィラメントL
ニューロフィラメント軽鎖(Neurofilament Light chain)。神経細胞の軸索突起に豊富に含まれる細胞骨格の成分である。
注7) Benatar et al., BRAIN 146; 2711–2716, 2023

 Home
Home