TEL: 082-257-5818
FAX: 082-256-7104
E-mail: ktashiro*hiroshima-u.ac.jp (*は半角@に置き換えてください)
本研究成果のポイント
- 放射線被ばくや薬剤などによる染色体異常は、白血病やがんの原因となることが知られています。
- 今回の研究で、DNA損傷シグナル制御因子ATMは、クロマチン構造変換複合体の構成因子であるARP8をリン酸化することで、修復因子の損傷DNAへの結合を適度に抑制していることがわかりました。すなわち、ATMは修復のアクセルとしての役割だけでなく、ブレーキとしても働くことで、修復の活性を適切なレンジに調整し、染色体異常を防いでいることが明らかになりました。
- 今回の研究成果は、DNA修復機構を制御することで、放射線被ばくや薬剤などによるがんを予防するという新しい医療の確立に繋がることが期待されます。
概要
広島大学原爆放射線医科学研究所の孫継英講師、田代聡教授らの共同研究チームは、放射線被ばくや薬剤による染色体の異常が形成されないようにする、傷ついたDNAを正確に修復するメカニズムを明らかにしました。
放射線被ばくや薬剤などにより傷ついたDNAの周辺では、DNAとヒストンなどのタンパク質からなるクロマチン構造が変化して、修復に関わる様々な因子が損傷DNAに結合するのを促進し、DNA修復を進めることが知られています。しかし、修復に失敗して、切れたDNAが間違った場所に繋がれて染色体転座が作られてしまうと遺伝子の構造を壊してしまい、白血病やがんの原因になります。特に、11番染色体転座は、抗がん剤エトポシドによる治療に関連する二次性白血病に特徴的な染色体異常として知られています。ただ、これらの染色体転座のメカニズムは不明でした。
今回の研究では、エトポシドによる11番染色体転座をモデルに、染色体転座のメカニズムの解明に取り組みました。その結果、DNA損傷シグナル制御因子ATMが、INO80クロマチン構造変換複合体(注1)の構成因子であるARP8をリン酸化することが、11番染色体転座を防ぐために重要であることがわかりました。ATMによるARP8のリン酸化が、INO80クロマチン構造変換複合体やDNA修復因子RAD51の損傷DNAへの結合を適度に抑制することで、染色体転座を防ぐことを明らかにしました。
今回の研究成果は、正確なDNA修復をおこなうための重要な分子機構を明らかにしたもので、放射線被ばくや薬剤の後障害である白血病やがんの発症予防法の確立に繋がることが期待されます。
この研究成果は、英国オンライン科学雑誌「eLIFE」に掲載されました。
5月15日、本件について、広島大学霞キャンパスにおいて記者説明会を行いました。
(注1)INO80クロマチン構造変換複合体:細胞核では、染色体DNAがタンパク質と結合してクロマチンという高次構造を作って存在しています。クロマチンは、DNAの修復や複製、遺伝子の転写などのDNA代謝を制御するために構造を変えることが知られており、この構造の変化を司る複数のタンパク質から構成されるタンパク質複合体のことをクロマチン構造変換複合体と呼びます。INO80クロマチン構造変換複合体は、クロマチン構造変換複合体の一つでINO80を中心とした複数のタンパク質からなるタンパク質複合体です。
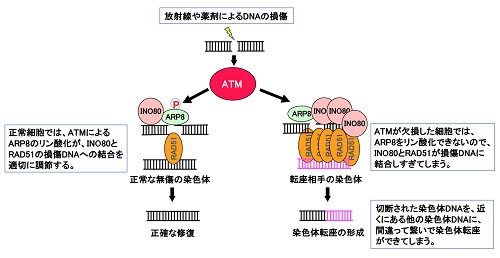
図 ARP8のリン酸化による染色体転座の抑制機構のモデル
ATMは、ARP8をリン酸化することで、クロマチン構造変換因子INO80やDNA修復因子RAD51などの損傷DNAへの結合を抑制している。ATMが働けないと、RAD51やINO80が過剰に損傷部位に結合し、染色体転座が形成されてしまう。
説明を行う田代教授(左)と孫講師(右)
記者説明会の様子
田代聡教授からのコメント
染色体異常は、放射線や抗がん剤により発症する白血病やがんの原因となります。今回の研究では、遺伝子の傷を正確に修復することができずに染色体異常が作られてしまうメカニズムについての新しい考え方を示すことができました。今後は、この研究の成果を白血病やがんの新しい予防法や治療法の確立に繋げていきたいと考えています。
論文情報
- 掲載雑誌: eLIFE
- 論文題目: Distinct roles of ATM and ATR in the regulation of ARP8 phosphorylation to prevent chromosome translocations.
- 著者: Jiying Sun1, Lin Shi1, Aiko Kinomura1, Atsuhiko Fukuto1, 5, Yasunori Horikoshi1, Yukako Oma2, Masahiko Harata2, Masae Ikura3, Tsuyoshi Ikura3, Roland Kanaar4, Satoshi Tashiro1*
1) 広島大学・原爆放射線医科学研究所・細胞修復制御研究分野
2) 東北大学・大学院農学研究科・分子生物学
3) 京都大学・放射線生物学研究所・クロマチン動態制御学分野
4) オランダ・Erasmus MC・Oncode Institute
5) 広島大学病院・眼科
*: 責任著者 - DOI番号: 10.7554/eLife.32222.001
広島大学原爆放射線医科学研究所細胞修復制御研究分野
教授 田代 聡

 Home
Home